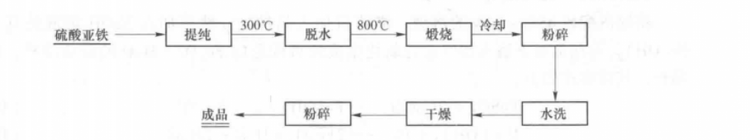
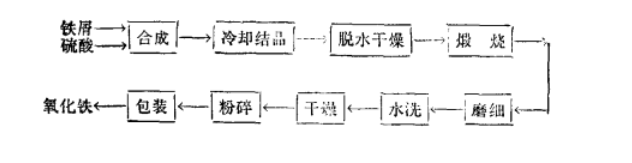
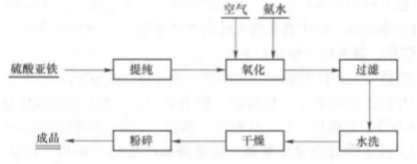
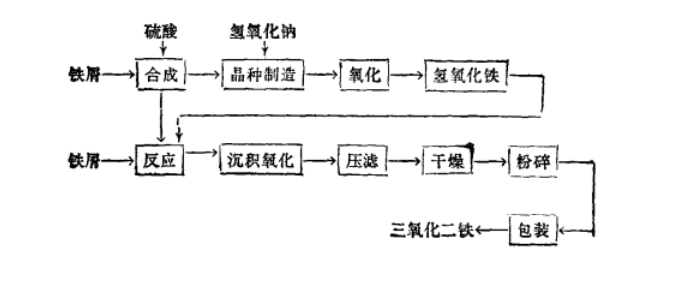
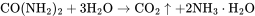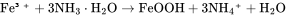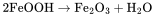自然存在 1.赤铁矿是广泛分布在各种岩石中的副矿物,以分散颗粒状存在于火成岩中,以菱面体、板状、致密块状等形状出现。世界赤铁矿的主要产地有英国、巴西、澳大利亚、美国、墨西哥和俄罗斯等地,其中较著名的有美国苏必利尔湖和克林顿、巴西的迈拉斯格瑞斯、俄罗斯克里沃伊洛格等地。
2.磁赤铁矿常以针状、板状以及云母片状生长于磁铁矿中。因此磁赤铁矿的分布与磁铁矿密切相关。
物质结构 氧化铁常以α-Fe₂O₃和γ-Fe₂O₃两种形式存在,其中α-Fe₂O₃为氧化铁的稳定存在形式,且α-Fe₂O₃在一定条件下可转换为γ-Fe₂O₃形式。而γ-Fe₂O₃则为较低温度下氧化得到的亚稳态形式,在一定温度下加热便会完全转换为α-Fe₂O₃形式。其中,对于二者的金属-氧键能,α-Fe₂O₃>γ-Fe₂O₃。
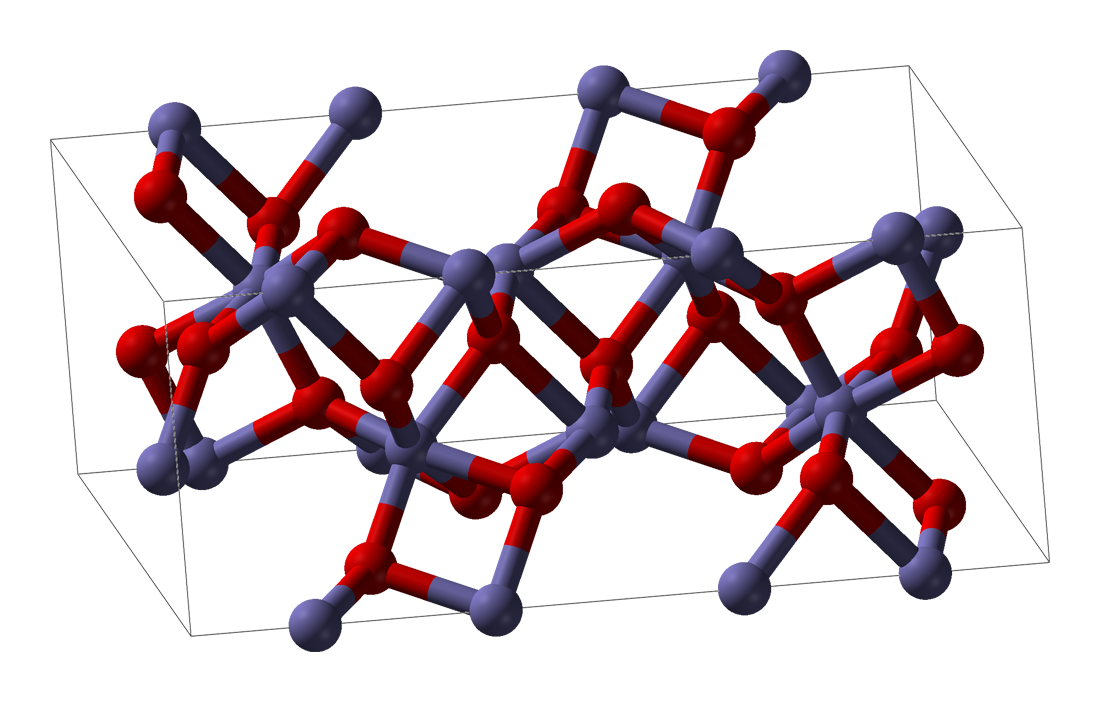
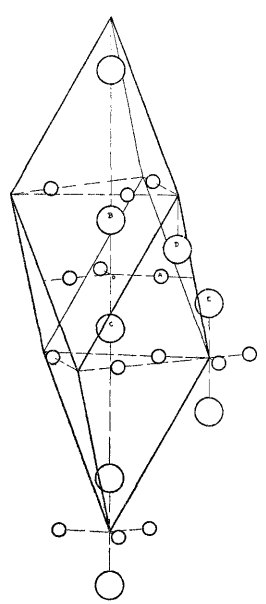
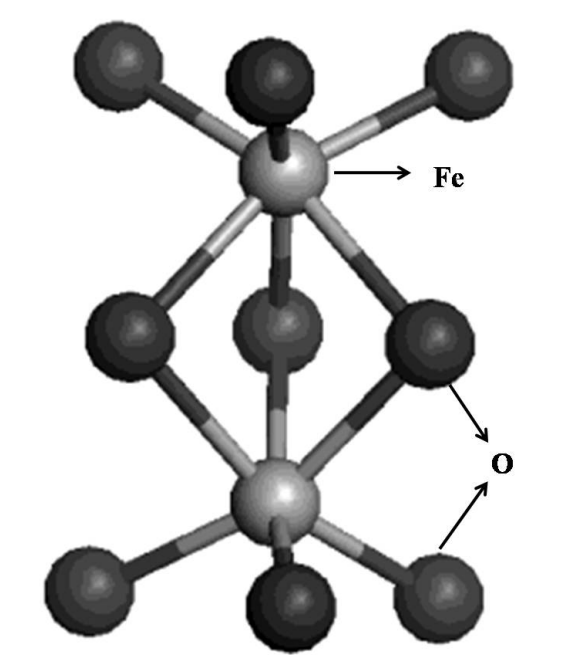
α-Fe₂O₃,也称赤铁矿,属于刚玉型三方晶系结构,Fe³⁺处于O²⁻形成的接近六方密堆积的空隙中,被六个相等距离的O²⁻包围,晶格参数a=5.0356nm,c=13.7489nm,每个晶胞有6个Fe₂O₃单元。在α-Fe₂O₃中,O²⁻沿六角形封闭晶格的(001)平面排列,而三分之二的八面体间隙被(001)基面上的阳离子Fe³⁺占据。
此外,α-Fe₂O₃是一种磁性比较复杂的物质,在121.1℃以上具有弱铁磁性,在121.1℃以下弱铁磁性会消失,反铁磁性会增加。α-Fe₂O₃和α-Al₂O₃(刚玉)的晶体结构十分类似。
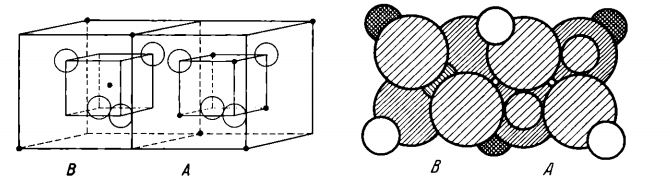
γ-Fe₂O₃,也称为磁赤铁矿,是氧化铁的低温亚稳态形式,属于立方晶系结构。γ-Fe₂O₃的晶体结构和Fe₃O₄晶体十分类似,晶体中的Fe³⁺分布在立方晶系结构中的氧原子的四面体中心A位置上和氧的八面体中心B的位置上。
理化性质 物理性质 纯氧化铁常温下为无味红棕色固体粉末,密度为5.24g/cm³,不溶于水和有机溶剂,可溶于盐酸、硫酸,微溶于硝酸。在标准的大气压力下,氧化铁的熔点为1565℃,氧化铁具有两种晶型,分别为稳定刚玉型三方晶系结构的α型晶体和亚稳定立方晶系结构的γ型晶体,氧化铁的折射率为3.19。
化学性质 与酸反应
氧化铁可与酸反应生成盐和水。
湿法
以精制后的氧化亚铁和氨水为原料混合,控制pH值在8.5-9之间,通入氧气使混合物进行氧化还原反应可获得γ-FeOOH晶体。该过程主要的化学反应方程式为:
纳米氧化铁 纳米氧化铁具有良好的光学性质、磁性和催化性能等,且具有低毒性、原料廉价易得、无污染等优点,被认为是多功能材料在许多行业中广泛使用。氧化铁纳米颗粒的制备方法,直接决定了其产物的微观形貌,纳米粒子的微观结构和性能表现。目前常见的纳米氧化铁制备方法有沉淀法,水热法和固液气液法。
其中沉淀法中常使用的方法为均匀沉淀法,均匀沉淀法合成纳米氧化铁的基本原理为:利用尿素和氯化铁溶液为原料进行反应,之后对反应产物FeOOH进行热处理获得最终产物纳米氧化铁。制备过程中的主要反应如下:
尿素发生分解:
铁离子发生沉淀:
对沉淀进行热处理:
采用均匀沉淀法所制得产品具有粒径分布区间小和颗粒分散较好的优点,并且可以通过控制煅烧温度,获得利用价值较高的中间产物FeOOH。
应用领域 催化 采用纳米氧化铁制成的催化剂的活性、选择性都高于普通的催化剂,并且寿命长、易操作,广泛应用于高分子氧化、还原和合成催化领域中。
磁带 矫顽力约为300奥斯特的γ-Fe₂O₃的微细粉末与树脂混合可作为磁记录的铁氧化物。将混合物涂抹在塑料胶片和AI板上,利用磁场中的涂敷技术,可以提高胶片的性能。γ-Fe₂O₃的形状具有各向异性可以稳定产生较高的矫顽力,与树脂混合时,磁性粉末更容易获得较高的填充密度。γ-Fe₂O₃的这一特性使之可以广泛的应用于录音磁带、计算机磁带、电影录音磁片和复制母带等磁性记录设备中。
磁性氧化铁具有特殊的超顺磁性,在巨磁电阻、磁性液体和磁记录、软磁、永磁、磁致冷、巨磁阻抗材料以及磁光器件、磁探测器等方面具有广阔的应用前景。
颜料 纳米氧化铁分散在透明介质中制成连续的薄膜时具有透明的着色效果,并且耐温、耐候、耐酸碱,广泛用作高档汽车面漆、建筑涂料、防腐涂料等。
医药 利用磁性α-Fe₂O₃纳米粒子在人体内的传输的特点制成药物载体,通过静脉注射到动物体内,在外加磁场作用下通过纳米微粒的磁性导航,使其移动到病变部位可达到定向治疗的目的。
检测 氧化铁可用于生产性能灵敏的传感器,用于检测H₂、乙醇、CO及其他有毒气体。在纳米α-Fe₂O₃中适当掺杂重金属(如Pb²⁺,Ni²⁺,Sn⁴⁺等)可提高其导性和灵敏度。
珠宝 赤铁矿加工制成的宝石折射率是所有宝石中最强的。大部分赤铁矿呈黑色、银灰色或深褐红色,对其进行抛光加工后,会使其表面会散发强的金属光泽,常被珠宝市场称作“黑钻”。片状集合体形式存在的赤铁矿会像绽开的玫瑰花瓣排列,因此赤铁矿也有有“铁玫瑰”的称号。
赤铁矿是在维多利亚时期欧洲十分受欢迎的宝石。美洲西部人民也会利用赤铁矿加工佩戴或摆件装饰品。
冶金 以氧化铁为原料,利用气体还原剂还原氧化铁可直接炼铁。20世纪60年代中期,工业上便开始采用该方法炼铁。
安全事宜 健康危害 吸入和摄入铁化合物会对人体肺部和胃肠道造成刺激。长期处在氧化铁粉尘的环境中,肺部会纤维化,肺功能受损严重。严重者会加大肺结核和肺癌的发病概率。
防护措施 在从事相关工业工作时,需要佩戴隐形眼镜或特定的眼部保护设备,防止化学烟尘污染眼部,同时佩戴口罩,避免吸入。
急救措施 若大量吸入氧化铁粉末,需尽快将患者转移至新鲜空气处,并保持患者呼吸畅通,必要时采取辅助通气。
若眼睛接触氧化铁粉末,需要立即用清水或生理盐水对眼睛进行冲洗。
若误食氧化铁,且患者没有强烈的呕吐反应,则需对患者进行漱口处理,并要求患者饮用一定量水稀释。