历史
发现
1754年,英国化学家约瑟夫·普里斯特利(Joesph Priestley)在加热氯化铵和石灰混合物时发现氨。1784年,法国化学家伯托利(C.L.Berthollet)确定氨是由氢和氮组成。
发展
1898年,弗兰克(A.Frank)等人发现碳化钙在氮气中加热到1000℃便可得到氰氨化钙,氰氨化钙与过热蒸汽反应便可得到氨。这种制氨的方法被人们称为氰化法,但这种方法所消耗的能量较高,所以并不经济。
1901年,吕·查得利(Le Chaterlier)在高压、高温的条件下合成了氨,虽然最终发生了爆炸,但开创了高压合成氨的先河。1909年,德国物理化学家弗丽茨·哈伯(Fritz Haber)使用锇为催化剂,在17.5MPa~20.0MPa和500℃~600℃的条件下合成了6%的氨。这成为了氨的合成从实验室到工业化的转折点。1911年,米塔西(Mittasch)成功研究出以铁为活性催化剂来合成氨,这种催化剂比锇作为催化剂廉价,活性高并且耐用。1912年,德国奥堡(Oppau)巴登苯胺纯碱公司建成一个日产30t的合成氨装置,1913年开始运转。
第一次世界大战德国战败后,被迫将合成氨的技术公开。经其他国家在此基础上进行改进后,出现了不同压力的合成氨的方法:低压法(10MPa)、中压法(20MPa~30MPa)和高压法(70MPa~100MPa),但大多数工厂采用的是中压法。
二次世界大战后,由于合成氨的需求量的增加以及石油工业和天然气工业的迅速发展,合成氨的原料逐渐用廉价的天然气、石脑油和重油来代替固体原料(如焦炭)。
氨的来源
自然界中的氨是由动物体和植物腐烂形成的,因为这些物质中含有蛋白质形式的氮。氨也是动物体新陈代谢的副产物,在这种情况下,它形成尿素并排出体外。
在海洋中,生物体中氨基酸中氮的价态为-3,从能量的角度看,-3价的无机氮容易被浮游植物或微生物通过光合作用或化能合成作用吸收利用,转化成有机氮。有机氮再通过呼吸作用,转化为无机氮,也就是氨。
微生物、藻类和与其共生的高等植物可以通过自身的固氮酶复合物把氮气转变为氨;土壤中的硝酸盐,亚硝酸盐以及铵盐可以通过植物根系进入植物细胞,被硝酸还原酶和亚硝酸还原酶催化转变成氨。
理化性质
物理性质
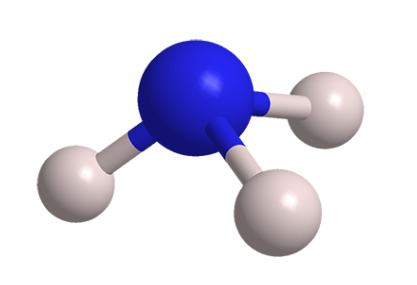
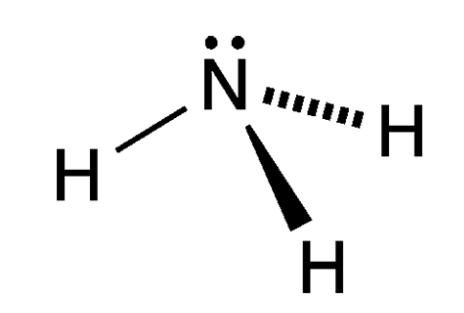
常温常压下,氨是一种具有强烈刺激性臭味的无色气体,摩尔质量为17.031g/mol,密度为0.5971g/cm,沸点为-33℃,熔点为78℃。氨极易溶于水、醇类、丙酮、三氯甲烷、苯等溶剂,常温常压下,一体积水可溶解700体积氨,溶解时放出大量热。
氨很容易被液化,在0.1MPa压力下,将氨冷却到-33.5℃,或在常温下加压到0.7~0.8MPa,氨就能液化成无色的液体,同时放出大量的热量。液氨的相对密度为0.667(20℃)。如果人与液氨接触,则会冻伤皮肤。若将液氨在0.101MPa压力下冷却至-77.7℃,就凝结成略带臭味的无色结晶。液氨也很容易气化,降低压力可急剧蒸发,并吸收大量的热。
化学性质
氨对大部分物质没有腐蚀性,但在有水的条件下,对铜、银、锌等金属有腐蚀作用。氨的自燃温度为630℃。氨与空气或氧按一定比例混合后,遇火能爆炸,氨在空气中的爆炸范围为15.5%~28%,在氧气中为13.5%~82%。氨有强烈的毒性,空气中含有0.5%(体积)的氨,就能在几分钟内使人窒息死亡。
自然界中的氨是由动物体和植物腐烂形成的,因为这些物质中含有蛋白质形式的氮。氨也是动物体新陈代谢的副产物,在这种情况下,它形成尿素并排出体外。
高温分解
在高温(800℃以上),氨能分解成氮和氢。
合成氢氰酸、尿素
氨与一氧化碳,或者与甲烷和氧反应生成氢氰酸。
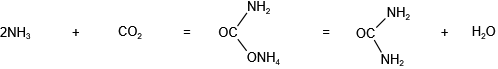
制备方法
实验室制法
氯化铵与消石灰共热,反应方程式如下:
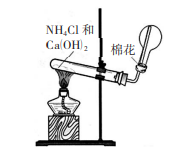
工业制法
氰化法
碳化钙在氮气中加热至1000℃得到氰氨化钙,氰氨化钙与过热蒸汽反应生成氨。反应方程式如下:

| 
| GHS分类
GHS | 危险说明 | 危险等级 |
H221 | 易燃气体 | 易燃气体 |
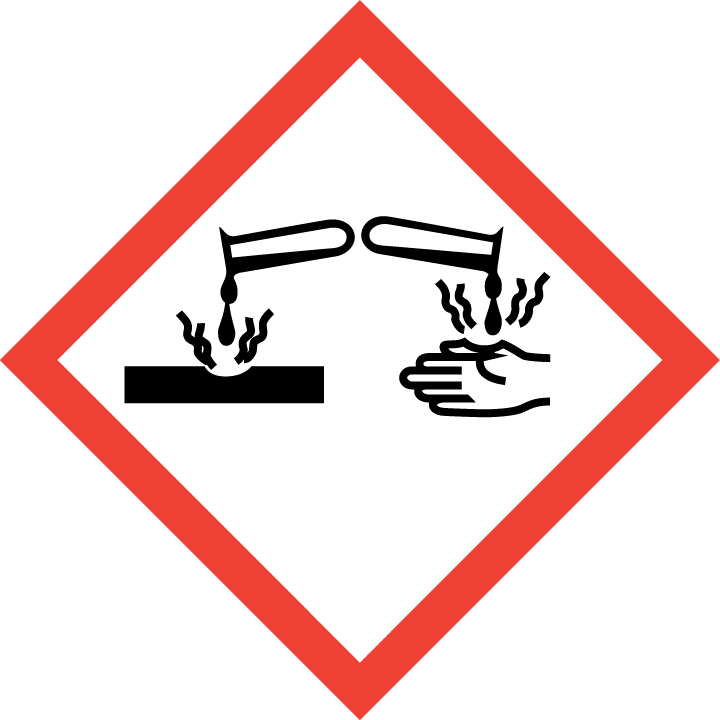
H314 | 造成严重的皮肤灼伤和眼睛损伤 | 皮肤腐蚀/刺激 |
H331 | 吸入有毒 | 急性毒性,吸入 |
H440 | 对水生生物剧毒 | 对水生环境有害,危害严重 |
储存
储存于阴凉、干燥、通风处。远离火种、热源。防止阳光直射。保持容器密封。应与酸类、金属粉末等分开存放。
泄露处理
氨发生泄露时,人员需迅速撤离泄漏污染区至上风处,并立即进行隔离150m,严格限制出入,切断火源,尽可能切断泄漏源。对泄露污染区合理通风,加速扩散。高浓度泄漏区,喷含盐酸的雾状水中和、稀释、溶解,并构筑围堤或挖坑收容产生的大量废水。如有可能,将残余气或漏出气用排风机送至水洗塔或与塔相连的通风橱内。储罐区最好设稀酸喷洒设施。漏气容器要妥善处理,修复、检验后再使用。
消防处理
消防人员必须穿全身防火防毒服,在上风向灭火,切断气源,若不能切断气源,则不允许熄灭泄漏处的火焰,喷水冷却容器,可能的话将容器从火场移至空旷处。灭火剂可以使用雾状水、抗溶性泡沫、二氧化碳、砂土。
健康危害
低浓度的氨对黏膜有刺激作用,高浓度可造成组织溶解性坏死,引起化学性肺炎及灼伤。轻度急性中毒者表现为皮肤、黏膜的刺激反应,出现鼻炎、咽炎、气管炎和支气管炎;可有角膜和皮肤灼伤。重度者出现喉头水肿、声门狭窄、呼吸道黏膜细胞脱落,气道阻塞而室息,可发生中毒性肺水肿和肝损伤。氨可引起反射性呼吸停止。如氨溅入眼内,可致晶体混浊、角膜穿孔,甚至失明。
急救措施
吸入:迅速脱离现场至空气新鲜处,保持呼吸道通畅,如呼吸困难,应输氧,如呼吸停止,立即进行人工呼吸,就医。
食入:给饮牛奶或催吐,有腐蚀症状时忌洗胃。
眼睛接触:应立即拉下眼脸,用清水或凉开水从眼眶上部流经眼球(避免直接冲击),反复冲洗至少10分钟,就医。
皮肤接触:应立即脱去污染衣物,用大量清水冲洗至少30分钟,严重者再用2%乙酸溶液进行中和或用2%硼酸溶液湿敷就医。