物理性质
苯甲醛 ,分子式为C7H6O ,微溶于水,可混溶于乙醇、乙醚、苯、氯仿。纯品为无色液体,工业品为无色至淡黄色液体,有苦杏仁气味。饱和蒸气压(kPa): 0.13(26℃),引燃温度(℃): 192 ,禁配物有强氧化剂、强酸、空气。 储存于阴凉、通风的库房。
化学性质
苯甲醛可被氧化为具有白色有不愉快气味的苯甲酸固体,在容器内壁上结晶出来。苯甲醇可通过氢化苯甲醛制备,也可由苯甲醛在氢氧化钾的醇溶液中进行自身氧化还原而得到(产物为苯甲酸钾和苯甲醇)。苯甲醛与无水醋酸钠和乙酸酐反应生成肉桂酸。氰化钾的醇溶液可用来催化苯甲醛的缩合,生成安息香。
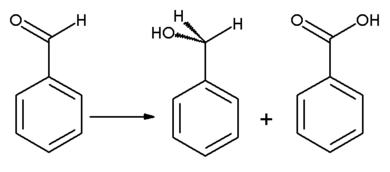
苯甲醛在浓碱溶液中进行歧化反应(康尼查罗反应,Cannizarro反应):一分子的醛被还原成相应的醇,另一分子的醛与此同时被氧化成羧酸盐。此反应的速度取决于芳环上的取代基。
扁桃酸的合成以苯甲醛为初始试剂:
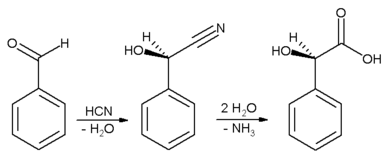
氢氰酸先与苯甲醛反应,产物扁桃,随后水解得到外消旋扁桃酸。
主要用途
是一种甲苯系中间体,用作医药(如麻黄碱)、香料等的原料,也用于制月桂醛、苯乙醛和苯酸苄酯等。
冰河学家LaChepelle和Stillman于1966年报导了苯甲醛和庚醛抑制冰的结晶,从而阻止浓霜(Depth Hoar)的形成。此处理方式可防止由于不稳定的积雪层而导致的雪崩。但是此化合物破坏植被且污染水源,并没有为此目的而被广泛使用。
生产方法
早期采用甲苯氯化再水解的方法生产,近年来,开发了甲苯直接氧化法。由于甲苯资源丰富、价廉,且氧化得到的苯甲醛香味较好,为香料制造者所喜用,此法逐步成为生产苯甲醛的主要方法。
甲苯氯化再水解法是将干燥的氯气通入沸腾状态的甲苯中,生成二氯甲苯。二氯甲苯和氧化锌、磷酸混合并加热至135℃,通入水蒸气使二氯甲苯水解生成苯甲醛,所得产物用稀纯碱液中和,得到含苯甲醛90%的油相,经水蒸气蒸馏提纯,得精制苯甲醛。由于该法需使用氯气,步骤多,现已较少使用。
甲苯直接氧化法同时生产苯甲醛和苯甲酸。由于甲苯氧化反应的途径是:
甲苯─→苄醇─→苯甲醛─→苯甲酸
苯甲醛是甲苯氧化制苯甲酸的中间产物,因而若氧化的目的是获得尽量多的苯甲醛,则反应必须在温和的条件下进行,以避免生成较多的苯甲酸。氧化反应过程分液相法和气相法。液相法通常采用氧化能力较弱的二氧化锰-硫酸为氧化剂进行部分氧化。也可以使用3~5当量浓度的稀硝酸在40~80℃的温和条件下反应 1~2h。这种方法的苯甲醛产率可达90%,只适于小规模生产。气相法是将甲苯蒸气与空气按1:14(质量比)混合,在常压和500℃的条件下,以短的接触时间通过氧化铀和氧化钼的载体催化剂进行氧化反应。反应气经冷凝得到粗苯甲醛,经过精制得到纯度98%的苯甲醛,按甲苯计收率为30%~50%。副产物有苯甲酸、顺丁烯二酸酐及蒽醌等。与液相氧化相比,气相氧化的催化剂再处理比较简单易行,因此各国正致力于气相氧化法催化剂的研究,并已取得一定的进展。
安全性
危害
健康危害: 本品对眼睛、呼吸道粘膜有一定的刺激作用。由于其挥发性低,其刺激作用不足以引致严重危害。
燃爆危险: 本品可燃,有毒,具刺激性。
危险特性: 遇明火、高热可燃。若遇高热,容器内压增大,有开裂和爆炸的危险。
有害燃烧产物: 一氧化碳、二氧化碳。
急性毒性: LD50:1300 mg/kg(大鼠经口)
急救措施
皮肤接触: 脱去污染的衣着,用流动清水冲洗。
眼睛接触: 提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入: 脱离现场至空气新鲜处。如呼吸困难,给输氧。就医。
食入: 饮足量温水,催吐。就医。
消防措施
灭火方法: 消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束。处在火场中的容器若已变色或从安全泄压装置中产生声音,必须马上撤离。
灭火剂:雾状水、泡沫、干粉、二氧化碳、砂土。
泄漏应急处理
迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防毒服。尽可能切断泄漏源。防止流入下水道、排洪沟等限制性空间。
小量泄漏:用砂土、蛭石或其它惰性材料吸收。也可以用不燃性分散剂制成的乳液刷洗,洗液稀释后放入废水系统。
大量泄漏:构筑围堤或挖坑收容。用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。