胰腺炎( Pancreatitis)是一种常见消化系统疾病,根据临床表现及发病急缓程度。可分为急性胰腺炎( Acute Pancreatitis,AP)与慢性胰腺炎(chronic pancreatitis,CP)。
本页面主要目录有关于胰腺炎的:解剖学、病因、发病机制、病理、疾病分型、临床表现、诊断、鉴别诊断、治疗、预后、流行病学、历史沿革等介绍
胰腺炎( Pancreatitis)是一种常见消化系统疾病,根据临床表现及发病急缓程度。可分为急性胰腺炎( Acute Pancreatitis,AP)与慢性胰腺炎(chronic pancreatitis,CP)。
本页面主要目录有关于胰腺炎的:解剖学、病因、发病机制、病理、疾病分型、临床表现、诊断、鉴别诊断、治疗、预后、流行病学、历史沿革等介绍
胰腺炎
Pancreatitis
腹痛、恶心呕吐、体重减轻等
急性胰腺炎、慢性胰腺炎
消化外科、消化内科、胰腺外科
酒精、高脂血症及胆道疾病等引起胰腺发生炎症
实验室指标:血清胰酶等、B超、CT、X射线
镇痛药、抗菌药物、胰酶抑制剂等
DC3-
急性胰腺炎轻者仅表现为胰腺水肿,临床多见,常呈自限性(self-limiting),预后良好。多以腹痛、腹胀、恶心呕吐等为主要临床表现,重者出现胰腺坏死,并发腹膜炎、休克,继发全身多器官功能衰竭,病死率高。慢性胰腺炎(chronic pancreatitis,CP)是多种原因所致胰实质和胰管的不可逆慢性炎症损害,其特征是反复发作的上腹部疼痛伴进行性胰腺内、外分泌功能减退或丧失。临床多表现为腹痛、体重下降、胰腺功能不全等。
急性胰腺炎发病因素较多,如胆道疾病、饮酒、代谢性疾病、十二指肠液反流、内镜逆行胰胆管造影(ERCP)及胰管空肠吻合口狭窄、肿瘤、药物创伤等。
慢性胰腺炎发病因素有长期大量饮酒和吸烟、胆道系统疾病、高钙血症及遗传、自身免疫、各种原因等。
急性胰腺炎的病理改变是胰腺呈不同程度的水肿、充血、出血和坏死,慢性胰腺炎则以胰腺腺体萎缩和纤维化,呈不规则结节样硬化主要病理学变化。
急性阑尾炎可分为轻、中、重型胰腺炎,也可分为早、后期急性胰腺炎,还可分为胆源性、酒精性、高脂血症性、外伤性、特发性急性胰腺炎。慢性胰腺炎可分为酒精性、复发性、遗传性及特发性慢性胰腺炎。
急性胰腺炎可通过实验室诊断(血清淀粉酶)、影像学检查(B超、CT等)及穿刺检查来明确诊断,慢性胰腺炎主要可通过胰腺功能检查及影像学检查明确诊断。
对于急性胰腺炎的治疗一般采用非手术及手术治疗,其中非手术治疗可通过补液、抑制胰腺分泌、抗感染、镇痛等方式缓解症状,也可通过引流及切除坏死组织等手术形式治疗AP。慢性胰腺炎可通过营养支持、培养良好生活习惯(戒烟戒酒低脂食物等)缓解症状,也可通过引流、切除胰腺等手术方式治疗CP。
轻症AP患者预后良好,一般1周可痊愈,中重症急性胰腺炎患者预后较好,重症急性胰腺炎患者病死率较高但应注意复发,慢性胰腺炎预后良好。
急性胰腺炎在全球的发病率不断升高。美国AP的发病率为5~30例/10万人中国,高甘油三脂血症性(HTG)胰腺炎发病率已升为AP第二大病因。慢性胰腺炎的发病率为9.62/10万,死亡率为0.09/10万,中国CP患病率为13/10万。
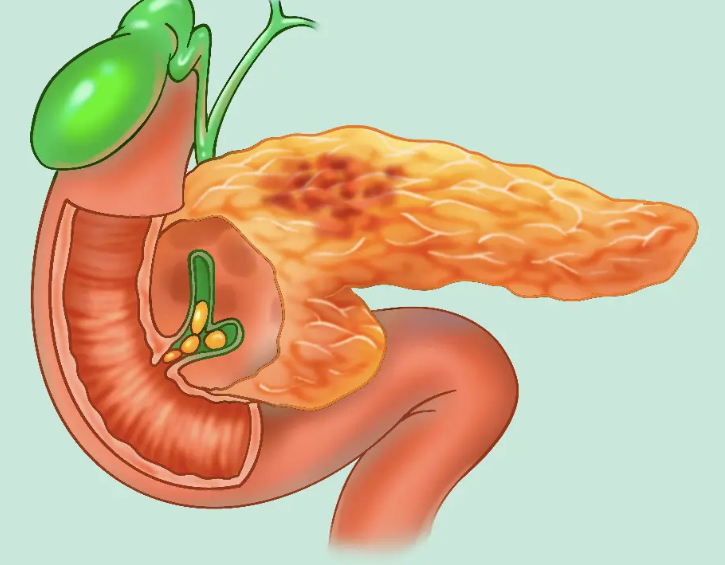
胰是一个狭长的腺体,质地柔软,呈灰红色,长17~20cm,宽3~5cm,厚1.5~2.5cm,重82~117g,位于腹上区和左季肋区,横置于第1~2腰椎体前方,并紧贴于腹后壁。胰的前面隔网膜囊与胃相邻,后方有下腔静脉、胆总管、肝门静脉和腹主动脉等重要结构。其右端被十二指肠环抱,左端抵达脾门。胰的上缘约平脐上10cm,下缘约相当于脐上5cm处。由于胰的位置较深,前方有胃、横结肠和大网膜等遮盖,故胰病变时,在早期腹壁体征往往不明显,从而增加诊断的困难性。
做为人体第二大的消化腺,胰由外分泌部和内分泌部组成。胰的外分泌部(腺细胞)能分泌胰液,内含多种消化酶(如蛋白酶、脂肪酶及淀粉酶等),有分解和消化蛋白质、脂肪和糖类等作用;其内分泌部即胰岛,散在于胰实质内,胰尾部较多,主要分泌胰岛素,调节血糖浓度。
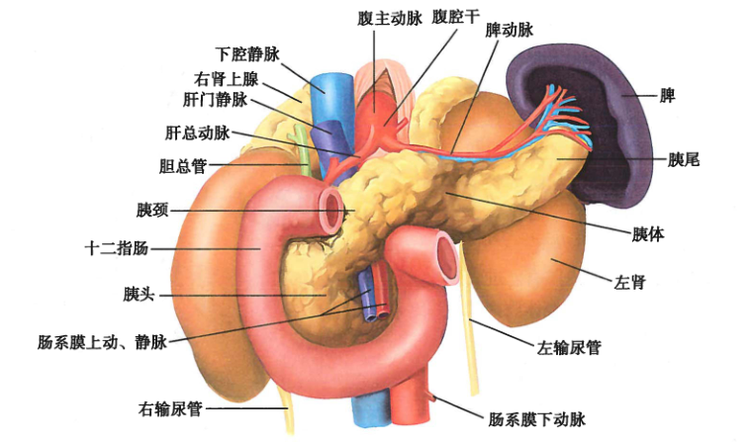
胰可分头、颈、体、尾 4 部分,各部之间无明显界限限。头、颈部在腹中线右侧,体、尾部在腹中线左侧,具体位置如右图所示。
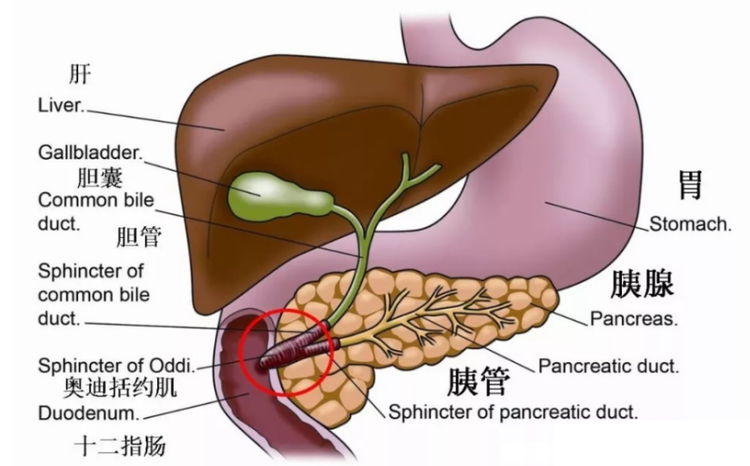
急性胰腺炎发病因素较多,少数病因不明者,临床上称之为特发性急性胰腺炎。
胆道疾病:为最常见的病因,也称胆源性胰腺炎。结石可阻塞胆总管末端,此时胆汁可经“共同通道”反流入胰管,此时胰蛋白酶原被激活,从而激活多种物质引起胰腺的“自我消化”,诱发急性胰腺炎。
诱发胆总管末端阻塞因素:炎症、手术操作引起的十二指肠乳头水肿或狭窄、俄狄式(Oddi)括约肌痉挛、肿瘤和胆道蛔虫等。
饮酒:乙醇不仅能直接损伤胰腺,还可刺激胰液分泌及引起十二指肠乳头水肿和Oddi括约肌痉挛,从而使胰管内压力增高,胰管破裂,最终诱发急性胰腺炎。
代谢性疾病:高脂血症性胰腺炎(高脂蛋白血症I、Ⅳ或V型)和/高钙血症(甲状旁腺功能亢进)及肾衰竭可诱发急性胰腺炎。正常人群如血脂高于11mmol/L,易诱发急性胰腺炎。
十二指肠液反流:多种原因造成十二指肠液反流至胰管,可诱发急性胰腺炎。
诱发十二指肠反流因素:十二指肠憩室、胆胰管解剖异常、环状胰腺、十二指肠炎性狭窄、胰腺钩突部肿瘤、胃大部切除术后输人袢梗阻、蛔虫性感染及其他梗阻因素。
医源性因素:内镜逆行胰胆管造影(ERCP)及胰管空肠吻合口狭窄也可能引发急性胰腺炎。
肿瘤:胰腺导管内乳头状黏液肿瘤(IPMN)、胰腺癌等可导致胰管梗阻从而发生急性胰腺炎。
药物:5-氨基水杨酸、硫唑嘌呤、6-巯嘌呤、阿糖胞苷、双脱氧肌苷、利尿药如呋塞米、噻嗪化物、雌激素、甲硝唑、丙戊酸、对乙酰氨基酚等药物可导致急性胰腺炎。
创伤:上腹部钝器伤、穿通伤、手术创伤等可诱发急性胰腺炎。
胰腺血液循环障碍:低血压、心肺旁路、动脉栓塞、血管炎以及血液黏滞度增高等因素均可造成胰腺血液循环障碍而发生急性胰腺炎。
其他发病因素:饮食、感染以及与妊娠有关的代谢、内分泌、遗传和自身免疫性疾病等。
长期大量饮酒和吸烟:是慢性胰腺炎最常见的危险因素,乙醇和烟草对胰腺具有直接毒性作用。
胆道系统疾病:胆道系统疾病常见的胆系疾病包括胆石症、胆胰壶腹括约肌功能紊乱、急慢性胆囊炎和胆管炎等,这些炎症或结石所致的胆胰管交界处狭窄或梗阻,直接导致胰液引流不畅,胰液大量积存于胰管中,引起胰管内高压,胰腺腺泡和小导管发生破裂,使胰液外溢,损伤胰腺组织和导管系统,胰管发生扭曲变形,造成炎症或梗阻。
高钙血症:可引起甲状旁腺功能亢进症并发慢性胰腺炎。
其他原因:遗传、自身免疫、各种原因造成的胰管梗阻均可能与本病发生有关,有少部分慢性胰腺炎病因不明。
腺泡内胰酶异常激活从而诱导胰腺发生实质的自身消化,在此基础上腺泡细胞释放多种炎性细胞因子引起炎症的级联反应。严重时胰腺局部可发生出血和坏死,继而引起全身炎症反应综合征(SIRS),甚至多脏器功能衰竭。
胰腺组织发生进行性的慢性炎症反应。
急性胰腺炎的病理改变是胰腺呈不同程度的水肿、充血、出血和坏死。
急性水肿性胰腺炎:病变轻,多局限在体尾部。胰腺肿胀变硬,充血,被膜紧张,胰周可有积液。腹腔内的脂肪组织,特别是大网膜可见散在粟粒状或斑块状的黄白色皂化斑(脂肪酸钙),腹水为淡黄色。镜下见间质充血、水肿并有炎性细胞浸润,有时可发生局限性脂肪坏死。
急性出血坏死性胰腺炎:病变以胰腺实质出血、坏死为特征。胰腺肿胀,呈暗紫色,分叶结构模糊,坏死灶呈灰黑色,严重者整个胰腺变黑。腹腔内可见皂化斑和脂肪坏死灶,腹膜后可出现广泛组织坏死。腹腔内或腹膜后有咖啡色或暗红色血性液体或血性混浊渗液。镜下可见脂肪坏死和腺泡破坏,腺泡小叶结构模糊不清。间质小血管壁也有坏死,呈现片状出血,炎细胞浸润。
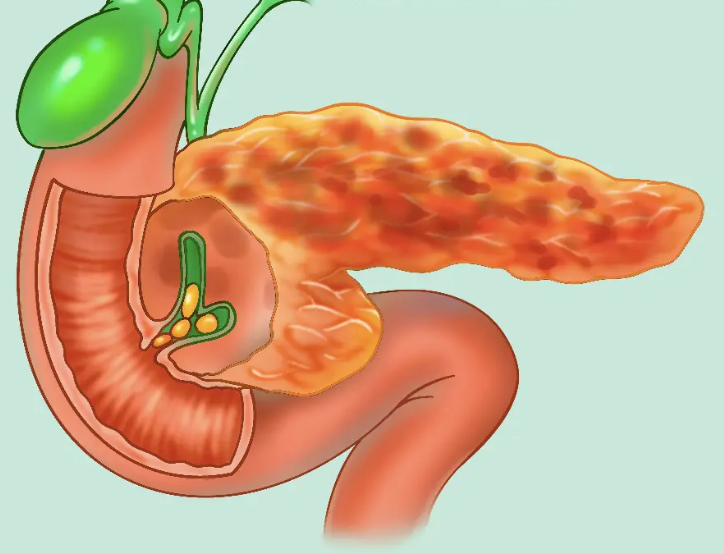
典型的病变是胰腺腺体萎缩和纤维化,呈不规则结节样硬化。胰管狭窄伴节段性扩张,可有胰石或囊肿形成。显微镜下见大量纤维组织增生,腺泡细胞缺失,胞体皱缩,钙化和导管狭窄,致密的胶原和成纤维细胞增生并将胰岛细胞分隔。少数病人可以在胰腺慢性炎症的基础上发生癌变。
严重程度分类
多为水肿性胰腺炎,无器官功能衰竭和局部或全身并发症。主要表现为上腹痛、恶心、呕吐,可有腹膜炎,但多局限于上腹部,体征较轻,经及时的液体治疗,通常在1~2周内恢复,病死率极低。
伴有一过性的器官功能衰竭(48小时内可以自行恢复),伴有局部或全身并发症。早期病死率低,后期如坏死组织合并感染,病死率增高。
伴有持续的器官功能衰竭(超过48小时),且不能自行恢复,涉及的器官包括呼吸系统、心血管和肾脏。SAP病人多为出血坏死性胰腺炎,腹膜炎范围大,腹胀明显,肠鸣音减弱或消失;偶见腰肋部或脐周皮下瘀斑征。腹水呈血性或脓性。严重者发生休克,出现多脏器功能障碍,病死率高达30%。
临床分期分类
根据急性胰腺炎的2个死亡高峰期,将急性胰腺炎分为早期和后期2个时期。
发病1周内,可延长至2周,主要病理生理变化为胰酶的异常激活导致的全身细胞因子瀑布样级联反应,临床表现为全身炎症反应综合征(SIRS),甚至可以发生多脏器功能障碍。
为发病1周后,病程可长达数周甚至数月,仅见于中度重症胰腺炎(MSAP)或重症急性胰腺炎(SAP)。临床表现为持续的SIRS,器官功能障碍或者衰竭,胰腺或者胰腺周围组织的坏死。
病医学分类
胆管结石梗阻或胆管炎炎、胆囊炎诱发的急性胰腺炎。患者首发症状多起自中上腹或右上腹,临床上50%以上的急性胰腺炎都是胆道疾病引起。
因酗酒引起的急性胰腺炎。
高血脂诱发的急性胰腺炎。
胆道或胃的手术、Oddi括约肌切开成形术,ERCP后诱发的急性胰腺炎。
病因不明的急性胰腺炎,多数是微小胆石引起。
还有药物性急性胰腺炎、妊娠性急性胰腺炎等。
CP患者平均乙醇摄入量男性超过80g/d、女性超过60g/d,持续2年或以上,且排除其他病因。
患者至少有两次急性胰腺炎发作史,缓解期无胰腺组织或功能异常改变,是一种特殊类型的胰腺炎。
CP患者家族中,在两代或以上的亲属中,存在至少2个一级亲属或至少3个二级亲属患CP或者RAP。
指排除任何已知病因的CP患者。
由于病变程度不同,病人的临床表现差异很大。
腹痛
为急性胰腺炎的主要症状,常于饱餐和饮酒后突然发作,腹痛剧烈,多位于左上腹,向左肩及左腰背部放射。胆源性者腹痛始发于右上腹,逐渐向左侧转移。病变累及全胰时,疼痛范围较宽并呈束带状向腰背部放射。
腹胀
多与与腹痛同时存在,早期多为神经反射性腹胀,继发感染多因腹膜后炎症刺激所致,其炎症越严重,腹胀越明显,腹腔积液时可加重腹胀,病人排便、排气停止。腹腔内压增高可导致腹腔间隔室综合征(abdominal compartment syndrome)。
恶心、呕吐
一般早期即可出现,呕吐往往剧烈而频繁,呕吐物为胃十二指肠内容物,偶可呈咖啡色,呕吐后腹痛不缓解。
腹膜炎体征
急性水肿性胰腺炎时压痛多只限于上腹部,常无明显肌紧张。重症急性胰腺炎腹部压痛明显,可伴有肌紧张和反跳痛,范围较广,可累及全腹。肠鸣音减弱或消失,腹腔渗液量大者移动性浊音为阳性。
其他症状
急性胰腺炎可不发热或轻度发热。合并胆道感染常伴有寒战、高热。胰腺坏死伴感染时,持续性高热为主要症状一。
胆道结石嵌顿或肿大胰头压迫胆总管可出现黄疸。
重症胰腺炎病人可有脉搏细速、血压下降,乃至休克。早期休克主要是由低血容量所致,后期继发感染使休克原因复杂化且难以纠正。
伴急性肺功能衰竭时可有呼吸困难和发绀。
胰腺坏死伴感染时,可出现腰部皮肤水肿、发红和压痛。少数严重病人胰腺的出血可经腹膜后途径渗入皮下,在腰部、季肋部和下腹部皮肤出现大片青紫色瘀斑,称Grey-Turner 征;若出现在脐周,称Cullen 征。
胃肠出血时可有呕血和便血。
血钙降低时,可出现手足抽搐。
严重者可有DIC表现及中枢神经系统症状,如感觉迟钝、意识模糊乃至昏迷。
并发症
急性胰周液体积聚(acute peripancreatic fluid collection,APFC):发生于病程早期,表现为胰周或胰腺远隔间隙液体积聚,并缺乏完整包膜,可以单发或多发。通常依靠影像学检查发现。影像学上为无明显囊壁包裹的急性液体积聚。急性液体积聚多会自行吸收,少数可发展为急性假性囊肿或胰腺脓肿。于病程早期,表现为胰周或胰腺远隔间隙液体积聚,并缺乏完整包膜,可以单发或多发。
急性坏死物积聚(acute necrotic collection,ANC):发生于病程早期,表现为混合有液体和坏死组织的积聚,坏她物包括胰腺实质或胰周组织的坏死。胰腺坏死根据感染与否又分为感染性胰腺坏死和无菌性胰腺坏死。增强CT是目前诊断胰腺坏死的最佳方法。在静脉注射增强剂后,坏死区的增强密度不超过50Hu(正常区的增强为50~150Hu)。发生于病程早期,表现为混合有液体和坏死组织的积聚,坏死物包括胰腺实质或胰周组织的坏死。
包裹性坏死(walled-off necrosis,WON):是一种包含胰腺和(或)胰周坏死组织、且具有界限清晰的炎性包膜的囊实性结构,多发生于AP起病4周后。包裹性坏死感染,主要表现为不同程度的发热、虚弱、胃肠功能障碍、分解代谢和脏器功能受累,多无腹膜刺激征,有时可以触及上腹部或腰胁部包块,部分病例症状和体征较隐匿,CT扫描主要表现为胰腺或胰周包裹性低密度病灶。有完整非上皮性包膜包裹的液体积聚,起病后4周,假性囊肿的包膜逐渐形成。
胰腺假性囊肿(pancreatic pseudocyst):有完整非上皮性包膜包裹的液体积聚,起病4周后假性囊肿的包膜逐渐形成。急性胰腺炎患者的假性囊肿少数可通过触诊发现,多数通过影像学检查确定诊断。常呈圆形或椭圆形,囊壁清晰。
以上每种局部并发症均分为感染性和无菌性两种情况,其中 ANC和WON继发感染又称为感染性坏死;⑤其他,包括胸腔积液、胃流出道梗阻、消化道瘘、腹腔或消化道出血、脾静脉或门静脉血栓形成等。是一种包含胰腺和(或)胰周坏死组织且具有界限清晰炎性包膜的囊实性结构,多发生于急性胰腺炎起病4周后。
包括SIRS、脓毒症(sepsis)、多器官功能障碍综合征(multiple organ dysfunctionsyndrome,MODS)及腹腔间隔室综合征等。
低血压及休克:重症者常有低血压及休克,患者烦躁不安,皮肤苍白、湿冷,呈花斑状,脉搏细弱,血压下降,少数患者可在发病后短期内死亡。
消化道出血可表现为呕血或便血。呕血是应激性溃疡或胃黏膜糜烂,或胃黏膜下多发性脓肿引起;便血可由胰腺坏死穿透横结肠引起,便血者预后极差。
细菌及真菌感染:重症患者的机体抵抗力低下,极易发生感染。感染一般出现在起病后2周至2个月内,可引起胰周脓肿、腹腔脓肿、败血症及呼吸道、泌尿道感染等。早期病原菌以革兰阴性菌为主,后期常为双重或多重细菌感染。大量使用广谱抗生素造成严重菌群失调时,加上机体抵抗力明显低下,极易引起真菌感染,常见病原菌为白念珠菌和酵母菌。
慢性胰腺炎和糖尿病慢性胰腺炎与胰腺腺泡大量破坏及胰腺外分泌功能不全有关,糖尿病发生与胰腺β细胞破坏、胰岛素分泌减少有关,发生率为4%。
代谢异常重症患者可有下列代谢异常:
低钙血症:约30%~60%患者出现,血钙〈2mmol/L(8mg/dl)。血钙<1.75mmol/L(7mg/dl)且持续数天者,预后多不良。其产生机制:磷脂酶A和脂肪酶激活,产生脂肪酸,脂肪酸与血钙发生皂化作用;重症时,白蛋白水平降低可使总钙的测定数值降低;降钙素分泌增加时血钙下降;钙-甲状旁腺轴失平衡,后者对低血钙的反应性减弱,钙被转移至脂肪、肌肉和肝组织中。
高脂血症:约20%患者可发生,患者可出现血清脂质微粒凝聚,产生脂肪栓塞。
糖代谢异常:约50%患者出现暂时性高血糖,30%患者有糖尿,偶可发生糖尿病酮症酸中毒或高渗性昏迷;1%~5%患者可并发低血糖,糖代谢异常与急性胰腺炎时胰岛素、胰高血糖素、生长抑素及糖皮质激素的浓度及相互作用有关。
血液学异常:包括贫血、DIC、门静脉和(或)脾静脉栓塞。重症急性胰腺炎时,患者纤维蛋白原和凝血因子Ⅷ升高,引起高凝状态,出现血栓形成和局部循环障碍,严重时可发生DIC。
心功能不全或衰竭:50%患者可有ST-T改变、传导阻滞、期前收缩为主的心电图变化。少数患者还可出现心力衰竭和严重心律失常。
肾功能不全或衰竭20%:重症患者可出现肾衰竭,与其有关的死亡率可达80%,发生原因与低血容量、休克和激肽-缓激肽系统作用有关。
呼吸功能不全或衰竭:是最严重的并发症。气急可能是呼吸功能不全的唯一症状,如不注意观察和及时诊断治疗,患者往往会发展到急性呼吸衰竭(成人呼吸窘迫综合征,ARDS),可有明显气急、发绀等,常规的氧气疗法不能缓解;血气分析PaO2〈8.0kPa(60mmHg)。为减少ARDS的发生和及早发现、及早治疗,建议在重症患者人院初期,每日至少做2次动脉血气分析。
胰性脑病发生率为5.9%~11.9%,表现为神经精神异常,定向力缺乏,精神错乱,伴有幻想、幻觉、躁狂状态等。常为一过性,可完全恢复,也可留有精神异常。
通常将腹痛、体重下降、糖尿病和脂肪泻称之为慢性胰腺炎的四联症。
腹痛
最常见的表现,疼痛位于上腹部剑突下或偏左,常放射到腰背部,呈束腰带状,疼痛持续的时间较长。
体重下降
食欲减退和体重下降是慢性胰腺炎的重要症状之一,主要由于畏食和惧怕进食引起腹痛所致。其次,严重的胰腺病变可引起胰酶分泌减少导致消化和吸收不良。
胰腺功能不全
脂肪泻是最常见的症状,这时粪便奇臭,量多且呈泡沫状,含大量脂肪颗粒。30%左右患者并发糖尿病,糖尿病患者一般早于脂肪泻。
其他
部分可有胰岛素依赖性糖尿病,也有因胰头纤维增生压迫胆总管而出现黄疸。
体征
上腹部压痛,急性发作时可有腹膜刺激征。当并发巨大假性囊肿时可扪及包块。由于消化吸收功能障碍可导致消瘦,亦可出现其他并发症相关体征。
并发症
胰源性门静脉高压和上消化道出血:可出现呕血和黑便,患者常伴脾脏肿大和脾功能亢进,表现为左上腹疼痛和血细胞减少,肝功指标正常且不会引起腹水;少数患者会出现消化道出血,严重者出现呕血、黑便,轻者仅有贫血和粪便隐血试验阳性。
胰腺假性囊肿:见于10%的患者,临床表现差异较大,可无任何症状,或仅有CP相关的腹痛、恶心呕吐、体重减轻。部分患者会出现相关并发症,如感染、囊肿自发破裂、囊内出血、胆总管或DO、胰源性门静脉高压、假性动脉瘤等。上述临床症状并非特异性表现,因此,PPC的诊断需通过CT、磁共、超声等影像学手段明确。超声内镜引导下细针穿刺抽吸术可对囊液进行分析,与恶性肿瘤相比,PPC囊液中淀粉酶和脂肪酶水平均较高,而癌胚抗原等肿瘤标志物水平较低。
胆道或十二指肠梗阻:见于5%~10%的患者,主要是由于胰头部炎症或纤维化、假性囊肿所致。当 CP患者出现恶心呕吐等梗阻表现时应考虑是否为胆道或十二指肠梗阻可通过内镜或X线钡剂造影等检查明确梗阻的原因和部位。
胰源性胸、腹水:形成的机制可能是由于胰管破裂,与腹腔和胸腔形成瘘管,或是假性囊肿的破溃致胰液进人胸、腹腔。胰源性胸、腹水可呈浆液性、血性或乳糜性,后两者较少见。胰源性胸腔积液以左侧多见,具有慢性、进行性、反复发作及胸腔积液量多的特点。
胰腺癌:约4%患者在20年内并发胰腺癌。
胰瘘:包括胰腺外瘘和内瘘。外瘘常发生于胰腺活检、胰腺坏死、外科引流术后、手术中的胰腺损伤或腹部钝伤后。内瘘常发生于慢性胰腺炎主胰管或假性囊肿破裂后,酒精性胰腺炎易出现内瘘。部分患者可无症状,有些出现疼痛、脓毒症等,甚至因积液压迫周围器官而引起其他并发症。通过影像学检查可发现瘘管或积液,对引流液进行实验室检查常见淀粉酶升高。
其他:少数患者可有胰性脑病;胰腺与脾粘连或胰腺假性囊肿侵蚀促发脾破裂;皮下脂肪坏死和骨髓脂肪坏死等。
实验室检查
胰酶测定:血清及尿中淀粉酶测定是最常用的诊断方法。血清淀粉酶在发病数小时开始升高,24小时达高峰,4~5天后逐渐降至正常;尿淀粉酶在24小时才开始升高,48小时到高峰,下降缓慢,1~2周后恢复正常。
血清脂肪酶:明显升高(正常值23~300U/L)具有特异性,也是比较客观的诊断指标。
其他项目:包括白细胞增高、高血糖、肝功能异常、低血钙、血气分析异常等。
诊断性腹腔穿刺若抽出血性渗出液,且淀粉酶值升高对诊断很有帮助。
C反应蛋白(CRP):增高(发病48小时>150mg/ml)提示病情较重。
血钙:由于急性坏死性胰腺炎周围组织脂肪坏死和脂肪内钙皂形成消耗了钙,所以,血钙水平的降低也侧面代表了胰腺坏死的程度。血钙降低往往发生在发病后的第2~3天后,如果血钙水平持续低于1.87mmol/L,预后不良。
血糖:急性胰腺炎早期,血糖会轻度升高,是与机体应激反应有关。后期,血糖维持在高位不降(超过11.0mmol/L),则是因为胰腺受到广泛破坏,预后不佳。
血红蛋白和血细胞比容:急性胰腺炎患者血红蛋白和血细胞比容的改变常常反映了循环血量的变化。病程早期发现血细胞比容增加>40%,说明血液浓缩,大量液体渗入人体组织间隙,表明胰腺炎病情危重。
影像学诊断
超声:彩超是鉴别胰腺炎的首选手段,可发现胰腺肿大和胰周液体积聚,易受胃肠气体干扰,可影响其诊断的准确性。
胰腺水肿:均匀低回声。
胰腺出血及坏死可能:粗大的强回声。
胆源性胰腺炎可能:胆道结石,胆管扩张。
CT扫描:是最具诊断价值的影像学检查。不仅能诊断急性胰腺炎,而且能鉴别是否合并胰腺组织坏死。
膜腺坏死:在胰腺弥漫性肿大的基础上出现质地不均、液化和蜂窝状低密度区。
MRI:可提供与CT类似的诊断信息。MRCP能清晰地显示胆管及胰管,对诊断胆道结石、胆胰管解剖异常等引起的胰腺炎有重要作用。
穿刺检查
腹腔穿刺:是一种安全、简便和可靠的检查方法,对有移动性浊音者,在左下腹和右下腹的麦氏点作为穿刺点,穿刺抽出淡黄色或咖啡色腹水,腹水淀粉酶测定升高对诊断有帮助。
胰腺穿刺:适用于怀疑坏死性胰腺炎继发感染者。一般在CT或B超定位引导下进行,将吸出液或坏死组织进行细胞学涂片和细菌或真菌培养,对确定是否存在坏死组织感染、何种细菌感染、采用何种抗生素及是否需要手术引流都有一定帮助。
诊断标准临
临床上符合以下3项特征中的2项,即可诊断为急性胰腺炎:
与急性胰腺炎临床表现相符合的腹痛。
血清淀粉酶和(或)脂肪酶活性至少高于正常上限值3倍。
符合急性胰腺炎的影像学改变。
可根据临床表现结合实验室及影像学检查明确诊断:
临床表现具体见临床表现项下。
实验室检查
粪便检查:可发现脂肪滴,有脂肪泻(每天摄入脂肪100g超过3天,粪便脂肪含量超过7g/d)。
粪便弹性蛋白酶-1测定:<200ug/g粪便提示胰腺外分泌功能不全。
影像学检查
计算机断层成像(CT):CT是CP诊断首选检查方法。对中晚期病变诊断准确性较高,对早期病变诊断价值有限。可见胰腺实质增大或萎缩、胰腺钙化、结石形成、主胰管扩张及假性囊肿形成十二指肠受压和胰源性门脉高压等征象。
超声与内镜超声(EUS):超声检查通常作为CP的初筛检查,可显示胰腺形态改变,胰管狭窄、扩张、结石或钙化及囊肿等征象,胰腺局限性结节,胰管扩张,囊肿形成,胰肿大或纤维化。合并胰管结石者可有强回声及伴随的声影。EUS除显示形态特征外,还可以辅助穿刺活检组织学诊断。
X线:胰腺区域可见钙化灶或结石影。
磁共振成像(MRI)和磁共振胆胰管成像(MRCP):MRCP可以清晰显示胰管病变的部位、程度和范围。胰泌素增强MRCP(secretin-enhanced MRCP)能间接反映胰腺的外分泌功能,有助于CP的早期诊断。
内镜逆行胆胰管造影(ERCP):除了可显示胰管扩张或呈串珠样改变外,还能发现胆胰管开口异常,并且可以进行穿刺活检、胰管引流。多被MRCP和超声内镜(EUS)替代,仅在诊断困难或需要治疗操作时选用。
胰管镜:可直接观察患者胰管内病变,同时能收集胰液、细胞刷片及组织活检等检查,对CP早期诊断及胰腺癌鉴别诊断有意义。
胰腺功能检查
胰腺外分泌功能检查:直接刺激试验静脉注射胰泌素1U/kg,其后收集十二指肠内容物,测定胰液分泌量及碳酸氢钠浓度。慢性胰腺炎患者80分钟内胰液分泌<2ml/kg(正常>2ml/kg),碳酸氢钠浓度<90mmol/L(正常>90mmol/L)。
Lundh试验:标准餐后十二指肠液中胰蛋白酶浓度<6IU/L为胰功能不全。
胰功肽试验(粪弹力蛋白酶):由于弹力蛋白酶在肠道不被破坏,其粪便中的浓度高于其在胰液中的浓度,当粪便中弹力蛋白酶<200ug/g时为异常。与以往的尿N-苯甲酰-L-酪氨酰对氨苯甲酸检测法比,不受尿量、服药、腹泻以及肾功能不全等因素的影响。
胰腺内分泌功能检查:继发于CP的糖尿病现归类为ⅢC型,诊断标准为糖化血红蛋白≥6.5%,空腹血糖≥7mmol/L,其他指标包括血清胰岛素及C肽等。这些指标通常在患者胰腺内分泌功能损失90%以上才出现变化,敏感性低。
诊断标准
一种及一种以上影像学检查显示CP特征性形态改变。
组织病理学检查显示CP特征性改变。
患者有典型上腹部疼痛,或其他疾病不能解释的腹痛,伴或不伴体重减轻。
血清或尿胰酶水平异常。
胰腺外分泌功能异常。
1或2任何一项典型表现,或者1或2疑似表现加3、4和5中任何两项可以确诊。1或2任何一项疑似表现考虑为可疑患者,需要进一步临床观察。
1.消化性溃疡急性穿孔:有较典型的溃疡病史,腹痛突然加剧,腹肌紧张,肝浊音消失,X线透视见膈下有游离气体等。
2.胆石症和急性胆囊炎:常有胆绞痛史,疼痛位于右上腹,常放射到右肩部,Murphy征阳性,血及尿淀粉酶轻度升高,B超及X线胆道造影可明确诊断。
3.急性肠梗阻:腹痛为阵发性,腹胀,呕吐,肠鸣音亢进,有气过水声,无排气,可见肠型,腹部X线可见液气平面。
4.心肌梗死:有冠心病史,突然发病,有时疼痛限于上腹部,心电图显示心肌梗死图像,血清心肌酶升高,血淀粉酶正常。
5.急性胃肠炎:有不洁饮食史,突然发病,脐周阵发性绞痛,伴呕吐、腹泻,无腰背部放射痛,血淀粉酶正常。
胰腺癌
血清CA19-9、CA125、CA50、CA242,在胰腺癌诊断中有一定参考价值,注意假阳性的存在。
胰液检查:通过ERCP获取胰液,如检出癌细胞,则确诊,同时胰液CA19-9及K-ras基因检测有一定鉴别诊断价值。
实时超声及EUS导引下细针胰腺穿刺,如发现癌细胞,可确诊。
CT、MRI和PET有助于鉴别。
消化性溃疡:十二指肠球部后壁穿透性溃疡可与胰腺粘连而引起顽固性疼痛。内镜捡查可鉴别。
原发性胰腺萎缩:多见于50岁以上的患者。无腹痛、脂肪泻、体重减轻、食欲减退和全身水肿等临床表现。超声及CT检查等一般能鉴别。
根据急性胰腺炎的分型、分期和病因选择恰当的治疗方法。针对不同病程分期和病因的治疗手段不断更新,使急性胰腺炎治愈率稳步提高。由于急性胰腺炎病因病程复杂,病情的严重程度相差极大,单一模式治疗方案不能解决所有的急性胰腺炎病例,因此,结合手术和非手术治疗为一体的综合治疗才能收到预期的效果。总体来说,以非手术保守治疗为主,在非手术治疗的基础上,有选择的手术治疗才能达到最好的治愈效果。总的治疗原则为:在非手术治疗的基础上,根据不同的病因,不同的病程分期选择有针对性的治疗方案。
非手术治疗
治疗原则:减少胰腺分泌,防止感染,防止病情进一步发展。单纯水肿型胰腺炎,经非手术治疗可基本治愈。
适应于:轻症胰腺炎及尚无外科干预指征的中度重症和重症急性胰腺炎。重症急性胰腺炎因病情危重和需要器官功能支持,往往需进入重症监护室治疗,必要时予以机械通气和床旁透析。
禁食、胃肠减压:持续胃肠减压可防止呕吐、减轻腹胀、降低腹内压。
补液、防治休克:静脉输液,补充电解质,纠正酸中毒,预防治疗低血压,维持循环稳定,改善微循环。
镇痛解痉:在诊断明确的情况下给予解痉止痛药,常用的解痉药有山莨菪碱、阿托品等,效果不明显的时候可以予以其他镇痛药物,如弱阿片类中枢镇痛药物、非甾体类镇痛药,吗啡虽可引起Oddi括约肌张力增高,但对预后并无不良影响。
抑制胰腺分泌:质子泵抑制剂(proton pump inhibitors,PPI)或H2受体阻滞剂,可间接抑制胰腺分泌;生长抑素(如octreotie)及胰蛋白酶抑制剂也有抑制胰腺分泌的作用。
营养支持:禁食期主要靠完全肠外营养(TPN)。待病情稳定,肠功能恢复后可早期给予肠内营养,酌情恢复饮食。
抗生素的应用:有感染证据时可经验性或针对性使用抗生素。常见致病菌有大肠埃希菌、铜绿假单胞菌、克雷伯菌和鲍曼不动杆菌等。
中药治疗:呕吐基本控制后,经胃管注人中药,常用复方清胰汤加减:银花、连翘、黄连、黄芩、厚朴、枳壳、木香、红花、生大黄(后下)。酌情每天3~6次,注入后夹管2小时。
手术治疗
急性腹膜炎不能排除其他急腹症时。
伴胆总管下端梗阻或胆道感染者。
合并肠穿孔、大出血或胰腺假性囊肿。
胰腺和胰周坏死组织继发感染。
最常用的是坏死组织清除加引流术。
可选用开放手术(经腹腔或腹膜后小切口途径)或使用内镜(肾镜,腹腔镜等)行坏死组织清除引流术。
开腹手术可经上腹弧形或正中切口开腹,进入网膜囊清除胰周和腹膜后的渗液、脓液以及坏死组织,彻底冲洗后放置多根引流管从腹壁或腰部引出,以便术后灌洗和引流。若坏死组织较多,切口也可敞开填塞,以便术后反复多次清除坏死组织。同时行胃造口、空肠造口(肠内营养通道),必要时可以行胆道引流术。后腹膜途径需术前影像学定位,经腰胁部侧方小切口进入脓腔进行坏死组织清除和引流术。若继发肠瘘,可将瘘口外置或行近端肠管外置造口术。形成假性囊肿者,可择期行内引流或外引流术。
目的:解除梗阻,畅通引流,依据是否有胆囊结石及胆管结石处理方法不同。
手术方式:仅有胆囊结石,且症状轻者,可在初次住院期间行胆囊切除。胰腺病情严重需要等待病情稳定择期行胆囊切除。胆管结石合并胆道梗阻,且病情较严重或一般情况差,无法耐受手术者宜急诊或早期内镜下Oddi括约肌切开、取石及鼻胆管引流术。
并发症的治疗
急性胰周液体积:大多数急性胰周液体积聚在发病后数周内可自发吸收,一般不发生感染。在这个阶段穿刺引流可继发感染,故应避免干预。仅在感染性急性胰周液体积聚时才有穿刺引流的指征。
假性囊肿:很少需要干预,仅在感染或有症状时考虑穿刺引流。临床上出现脓毒血症、CT检查出现气泡征、细针穿刺抽吸物涂片或培养找到细菌或真菌时,可诊断为感染性坏死。
胰腺假性囊肿和胰腺脓肿:EUS引导下胰腺假性囊肿和胰腺脓肿穿刺引流术已在临床广泛应用,能对胰腺假性囊肿、胰腺脓肿进行准确的定位评估,并对进针过程实时监测,可准确穿刺并引流病灶,与传统引流术及外科手术相比,创伤小,安全性高,且术后并发症较少。
发生全身炎症性反应(SIRS)时应早期应用乌司他丁或糖皮质激素。持续性肾脏替代疗法(CRRT)能很好地清除血液中的炎症介质 ,同时调节体液、电解质平衡 ,因而推荐早期用于A P并发的SIRS,并有逐渐取代腹腔灌洗治疗的趋势。SA P合并腹腔 间隔室综合征者应采取积极的救治措施 ,除合理的液体治疗 、抗炎药物的使用之外 ,还可使用血液滤过 、微创减压及开腹减压术等。
低血压及休克:除一般的生命体征监测外,尿量、中心静脉压、肺动脉楔压、血气分析等指标需特殊检测。在中心静脉压或肺动脉楔压监测下指导扩容治疗,早期足量补充血容量,开始补充晶体液为主,适当增加胶体,如白蛋白或血浆,酌情使用利尿剂、扩血管药物、改善微循环药物,如低分子右旋糖酐、丹参液等,必要时使用西地兰等强心药物。
消化道出血:当出现消化道出血时应及时输血、质子泵抑制剂及输液来纠正血容量不足。
细菌及真菌感染:预防性抗生素应用非常重要,应有针对性选用能通过血胰屏障的抗生素,如头孢类、喹诺酮类及甲硝唑等。菌血症或脓毒症者应根据药敏结果调整抗生素 ,要由广谱抗生素过渡使用至窄谱抗生素 ,要足量足疗程使用 。真菌感染时可用抗真菌药物如氟康唑等。
肾功能不全或衰竭:在治疗SAP的过程中应尽早预防肾缺血,避免使用肾毒性药物。发生肾功能不全后,应积极控制入量,采用低蛋白、高热量、高维生素营养,纠正水、电解质紊乱和酸中毒等,严重者需采用血透和腹膜透析等措施。
呼吸功能不全或衰竭:血气分析和血氧饱和度(SaO2)的监测应作为常规,如肢体末梢SaO2低于92%时应警惕ARDS的发生,临床上病人可出现呼吸频速及心动过速,胸片显示肺血管充血进行性加重至弥漫性浸润,严重低氧血症伴低碳酸血症。进行强有力的机械通气对ARDS的治疗起决定性的作用,一旦诊断ARDS,应及时行气管插管,采用呼气末正压通气(PEEP)方式辅助呼吸,同时要注意对SAP的控制和全身支持治疗。
其他:出现肝功能异常时可予以保肝药物 ,弥散性血管内凝血 (DIC ) 时可使用肝素 。
非手术治疗
病因治疗:戒绝烟、酒。
镇痛:应予以非甾体类抗炎药物开始,如有必要,可用曲马多或者丙氧酚类镇痛药物。只有在上述药物仍无法缓解疼痛的情况下,才能使用麻醉镇痛药物,但是要注意药物成瘾。
饮食疗法:少食多餐,高蛋白、高维生素、低脂饮食,控制糖的摄入。
补充胰酶:消化不良,特别对脂肪泻病人,应给予大量外源性胰酶制剂。
控制糖尿病:控制饮食,必要时采用胰岛素替代疗法。
营养支持:长期慢性胰腺炎多伴有营养不良。除饮食疗法外,可有计划地给予肠外和(或)肠内营养支持。
手术治疗
减轻疼痛,延缓疾病的进展,但不能逆转病理过程。慢性胰腺炎合并胆道梗阻,十二指肠梗阻和怀疑癌变者,应尽早手术。
适应症:
经十二指肠行Oddi括约肌切开术,解除壶腹部狭窄,使胰管引流通畅;也可经ERCP行此手术。
胰管空肠吻合术:常用术式有Partington手术即全程切开胰管,取出结石,胰管与空肠侧侧吻合。
适应症:有严重胰腺纤维化而无胰管扩张者。
手术方式:根据病变范围选用以下术式。
胰体尾部切除术,适用于胰体尾部病变。
胰十二指肠切除术(Whipple手术),适宜于胰头肿块的病人,可解除胆道和十二指肠梗阻,保留了富有胰岛细胞的胰体尾部。
全胰切除术:适用于病变范围广的顽固性疼痛病人。半数以上病人可解除疼痛,但术后可发生糖尿病、脂肪泻和体重下降,病人需终生注射胰岛素及口服胰酶制剂。
治疗目的:可以切除胰头炎性病变部位,解除对周围器官的压迫,缓解疼痛,又可以保证胰管引流,最大限度的保留胰腺内外分泌功能的同时保留了胆总管和十二指肠的完整性。
手术方式
Frey手术,局限性胰头切除+胰管全程纵行切开空肠吻合。
Berne手术,局限性胰头切除+胰头创面空肠吻合术,不做全程胰管纵行切开。
Beger手术,胰颈横断,胰头次全切除,分别行胰头创面、远端胰腺和空肠吻合。
此外,对顽固性剧烈疼痛,其他方法无效时,可施行内脏神经切断术或内脏神经节周围无水乙醇等药物注射,以控制疼痛。
并发症
胰源性门静脉高压和上消化道出血可出现呕血和黑便:消化道出血重在预防,应积极治疗CP和可能引发出血的并发症(如PPC、假性动脉瘤)。对于SVT和SPH引起的消化道出血,脾切除术是最有效的根治方法,有手术禁忌证的患者可采取药物(血管加压素、生长抑素、质子泵抑制剂等)治疗、内镜(硬化剂注射、静脉套扎等)治疗等。
胰腺假性囊肿(PPC):PPC的治疗方式主要为支持治疗、内镜治疗和外科手术治疗。引起症状和(或)并发症、无症状但最大径>5cm且未在一定时间内消退的PPC需进行内镜介入或外科手术治疗。
胆道或十二指肠梗阻:确梗阻的原因和部位。AP引起的短暂性梗阻可在保守治疗后解除,PPC相关的持续性梗阻可通过内镜介入引流得到改善。
胰腺癌: 积极治疗CP、戒烟、戒酒、控制体重等措施有助于降低胰腺癌的发生风险。
胰瘘:首先引流积液,控制感染,稳定生理状态,再确定胰管损伤的位置和程度,对瘘管进行处理。70%~82%的胰瘘经过引流可自行闭合,其余需进行内镜介入(如支架植入、生物胶封闭)或手术治疗。
急性胰腺炎的总体病死率为1%~2%,轻症AP患者预后良好,一般1周可痊愈,中重症急性胰腺炎患者预后较好,重症急性胰腺炎患者病死率较高,为34%~55%。中度重症AP患者常因并发症(如急性胰周液体积聚或急性坏死性积聚)导致住院时间延长,但局部并发症无腹痛等症状或感染证据,也不需要特殊治疗,大部分在数月自行吸收,病死率较低。重症AP患者预后较差,病死率可达30%,早期发生的器官功能衰竭和后期并发的感染性胰腺坏死是主要死因。中度重症AP和重症AP患者远期可能继发糖尿病,胰腺外分泌功能不全,生命质量降低。
慢性胰腺炎诊断后的20~25年内死亡率为50%,15%~20%的患者死于并发症。
AP在全球的发病率不断升高。美国AP的发病率为5~30例/10 万人,是胃肠病患者住院治疗的主要原因,每年因 AP 入院的患者数达275000 例,总费用达26亿美元。
在中国,高甘油三脂血症性(HTG)胰腺炎(hypertriglyceridemic pancreatitis,HTGP)发病率也在逐步升高,现已升为 AP第二大病因。北京HTGP位居病因第 2 位(10.36%),江西省HTG占所有病因的14.3%,2012 年之后 HTG 在 AP 病因中占比达17.5%。中青年男性、肥胖、饮酒嗜好及糖尿病患者是HTGP发病的高危人群。
在全球范围内,CP的发病率为9.62/10万,死亡率为0.09/10万,CP患者中以男性为主,其数量约为女性的2倍;美国成人CP发病率为24.7/10万,患病率为91.9/10万;日本CP发病率为14/10万,患病率为52/10万;印度CP的患病率最高,达到125/10万。中国CP患病率为13/10万。
命名
最早把胰腺作为一个独立的器官进行认知的是希腊人,尽管当时他们对于胰腺的功能并无概念。众所周知,Galen对胰腺做了一个模糊的描述,但Hippocrates也对胰腺相关的疾病有了最初的认识。对胰腺的最初认识应该归功于古希腊的Herophilus,时间大约在公元前300年。而同样来自古希腊的Rufus第一次将此器官命名为“pancreas”,单词取自希腊语Pan(意为“全部”)和希腊语Kreas(意为“肉”)。“pancreas”这个单词,顾名思义,意思就是“全都是肉”。古人给它这样的名字,大概是因为他们发现该器官中没有骨或软骨,各部位的组成相对统一。
解剖学与相关研究
1642年,意大利的一位解剖员Johann GeorgeWirsung描述了人类胰腺的主要导管系统,并以自己的名字命名,这使他在医学史上名垂千古。
Albrecht Von Haller(1708~1777年)发现与胆管汇合后通向肠腔,由此提出的胰液功能之一应该是稀释胆汁并降低其刺激性。1742年,Santorini阐明了副胰管的结构,并以自己的名字命名。历史上第一次引起学术界关注的有关胰腺的胚胎学研究是由Meckel在1806年进行的,而胰腺的比较解剖学研究于1861年由Goette第一次报道。
来自德国汉堡的WillyKuhne(1837~1900年)对于胰液能够消化蛋白质这一现象进行了观察,在此基础上他发现了胰蛋白酶。脂肪酶则是在1815年由一位伦敦的临床医师Alexander Marcet(1770~1822年)发现的。Arthur Salomon Loevenhart(1878~1929年)在1900年阐明了脂肪酶的作用有可逆性。Theodor Schwann发现了胃蛋白酶。
疾病史
西方历史上有史料记载的第1位AP患者是一位重要人物——古希腊的亚历山大大帝(Alexander the Great)。公元前323年,在巴比伦的一次酗酒之后年仅33岁的亚历山大大帝突然患病,并于10天后去世。根据他当时的症状 (暴饮暴食之后腹痛、发热和休克)。
中国中医典籍《黄帝内经》中,AP被分为“厥心痛”(轻症)和“结胸”(重症)两大类,前者仅有腹痛症 状;后者有“冷汗淋漓,脉微肢厥”等休克表现。
疾病分型
1992年问世的亚特兰大分类将AP分为轻症急性胰腺炎(mild acute pancreatitis,MAP)和重症急性胰腺炎(severe acute pancreatitis,SAP)。
美国麻省总医院的Fitz教授在1889年根据手术和尸检所见,将53例SAP患者分为出血性、化脓性和坏疽性3类。
Woolsey在1903年对141提出出血和脂肪坏死是SAP的病理基础。
1983年,剑桥分类根据有无局部或全身并发症,将AP分为轻症和重症。
病因
1788年Cawley首次阐述了酒精和胰腺疾病的关系,其在文献中报道了1例长期酗酒的34岁男性患者死于糖尿病和消瘦,该患者尸检发现胰腺广泛钙化、胰腺结石,但当时尚未提出胰腺慢性炎症的概念。
1878年Friedrich认为胰腺的慢性炎症可能与长期摄入乙醇有关,提出“嗜酒者胰腺”(Drunkard's pancreas)的概念。
1946年美国Mayo医学中心的Comfort首次系统地阐述了慢性胰腺炎的临床特点,包括反复发作的腹痛以及胰腺内外分泌功能的损害。
1952年Comfort和Steinberg首次报道了一个慢性胰腺炎家族,提出“遗传性胰腺炎”(hereditary pancreatitis)的诊断。
1955年Zuideman首次提出“热带性胰腺炎”(tropical pancreatitis)的概念,主要发生于热带地区的发展中国家,可能与低蛋白质、脂肪摄入不足等营养因素有关。
胰管减压引流术,最初是1954年DuVa、Zollinger施行脾脏、胰尾切除及胰腺空肠吻合术以从胰尾部逆行引流胰管,该术式方法简单,适于慢性胰腺炎伴明显胰管扩张者。1958年Puestow在DuVa基础上,采用切开扩张胰管行空肠侧侧吻合术。Partinogon-Rochelle胰管空肠Roux-en-Y 吻合手术将胰管全程切开行空肠吻合,由于广泛切开,引流充分,效果好,是近年来广泛采用的基本术式。
1973年和1974年分别由Kawai、Classen等首先报道了内镜下乳头括约肌切开术(endoscopic sphinctero papillotomy,EST),此项在ERCP诊断技术基础上发展起来的内镜治疗方法,通过高频电切开十二指肠乳头括约肌末端部分,成为胰腺疾病治疗的基本技术。
1983年Seigel等率先利用ERCP技术在胰管内放置支架治疗慢性胰腺炎胰管狭窄获得成功。
新亚洲娱乐(英文名:ASIA ENTERTAINMENT GROUP LIMITED,全称:新亚洲娱乐联盟集团有限公司)是一家以从事戏剧制作人及杂项戏剧服务为主的企业,成立于1999年,位于香港特别行政区。旗下分公司包括虎威艺能创作有限公司(TGS HK)、稻草人娱乐创作社(Scarecrow Entertainment)、虎威王朝音乐创作股份有限公司(TGS Music)、虎威活力娱乐传播有限公司(TGS Taiwan)、AK Entertainment(Korea)以及AEG Korea等。
印度孟买SENSEX30指数(又称孟买敏感指数)为印度最被广泛使用的指数,为投资印度的重要参考指标,是由孟买证券交易所发行。由于各类媒体提到的“印度股市”,实际上都是孟买股票交易所,因此,该交易所的SENSEX-30指数几乎成了印度股市的代名词。







