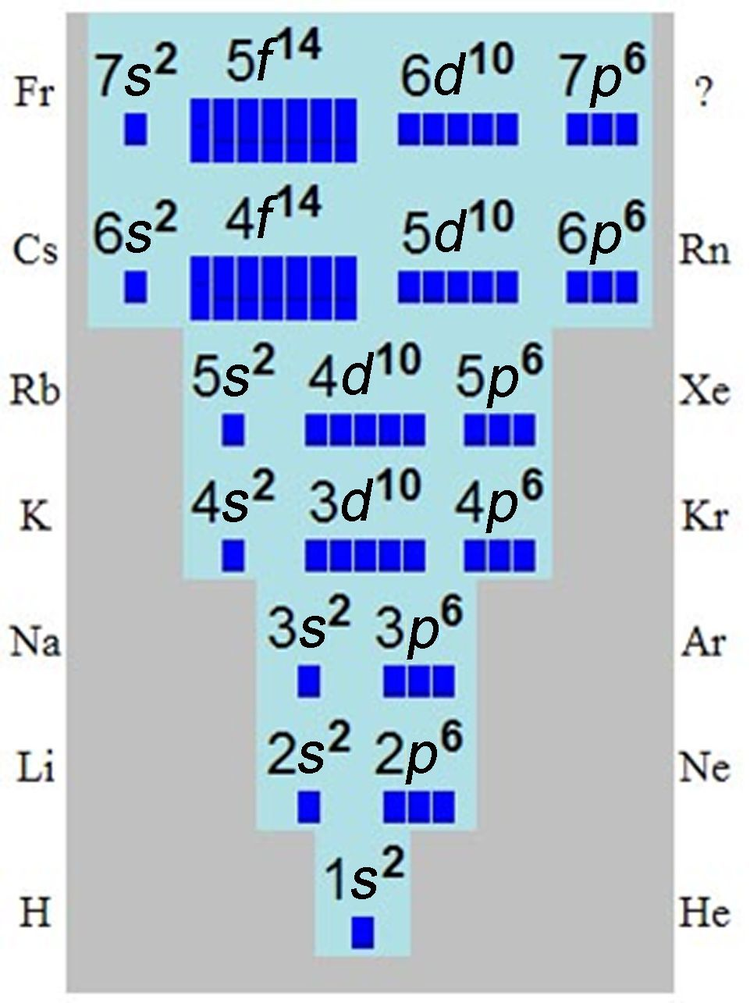
简介
1803年,英国科学家道尔顿(Dalton,1766-1844)提出了原子学说以及世界上第一个有关原子的理论模型。但道尔顿原子学说没有说明原子和分子的区别,也未能阐释原子的具体组成和结构。20世纪初比较有代表性的原子结构模型包括汤姆逊葡萄干布丁原子模型(Plum pudding model,1901年)、长冈半太郎土星模型(Nagaoka Hantaro,1903年)、卢瑟福的有核模型(Rutherford model,1909年)、尼尔斯·玻尔氢原子模型(Niels Henrik David Bohr model,1913)和埃尔温·薛定谔(Erwin Schrödinger)电子云模型。原子有核结构的发现宣告了原子核物理学的诞生。玻尔在核式原子结构模型的基础上,将量子化概念应用于原子系统加速了量子论的发展,而薛定谔电子云模型是原子模型的真正量子力学描述。
相关概念
原子是由带正电荷的原子核和带负电荷的电子构成。原子核所带的正电荷数(即核电荷数)与原子核外电子所带的负电子数相等,故原子呈电中性。原子可以构成分子,也可以形成离子,也可以直接构成物质。
亚原子粒子
亚原子粒子,其结构比原子更小,包括原子的组成部分如电子、质子和中子等许多其他奇特的粒子。总地来说,亚原子粒子可能是电子、中子、质子、介子、夸克、胶子和光子等。
原子核
原子核(atomic nucleus)是由质子(Proton)和中子(Neutron)组成。质子是带正电的基本粒子,它就是氢原子核,质子的静止质量为1.673×10kg,电量为1.602×10库伦(C),半径约为0.8×10m,质子常用符号H表示。质子还可以继续分解,根据美国物理学家盖尔曼(Murray Gell-Mann)的夸克模型,质子内部有三个更基本的粒子,称为“夸克”。原子核中质子数目决定其化学性质和它属于何种化学元素。在现有的理论下,夸克和电子都是不可再分的,它们都是最基本的粒子。中子(neutron)作为组成原子核的基本粒子之一,不带电,因此被称为中子。中子的静止质量为1.675×10kg,它的半径约为0.8×10m,与质子大小类似。中子常用符号n表示。宇宙中的中子星只有中子组成,密度大到惊人,直径只有几公里的中子星质量便可以达到太阳的好几倍。
原子的质量主要就集中在原子核,占到99.96%以上原子的质量。原子核体积极小,直径在10至10m之间,体积只占原子体积的几千亿分之一。原子核的密度极大,约为1014g/cm,构成原子核的质子和中子之间存在介子。原子核的能量极大, 当原子核发生裂变或聚变时,会释放出巨大的原子核能,即原子能。
电子云
由于电子在原子核外同不区域出现的概率不同,通常用小黑点来表示核外电子在某处出现的几率大小。小黑点密,说明电子云密度值大,即电子在该处出现的几率大;小黑点疏,说明电子云密度值小,即电子在该处出现的几率小;电子出现机会最大的区域,就是电子云密度最大的地方。把电子出现的几率相等的地方联接起来的线,称为等密度线,亦称电子云的界面,这个界面所包括的空间范围称为原子轨道。
历史沿革
古希腊
留基伯(Leucippus)是古希腊时期的哲学家,爱奥尼亚学派中的学者,约公元前500年出生,公元前400年左右去世。留基伯是原子论(atomism)的创始人和奠基者,是第一个提出原子是本原的人并对原子论基本框架理论进行了梳理和建构。留基伯认为世界的本原是原子和虚空,原子是最小的、不可分割的物质粒子。原子之间存在着虚空,无数原子从古以来就存在于虚空之中,既不能被创生,也不能被毁灭,它们在无限的虚空中运动着构成万物。
德谟克利特(Democritus,约公元前460年一公元前370年),古希腊哲学家,是留基伯的学生。他继承并发展了留基伯的原子学说,指出宇宙空间中除了原子和虚空之外,什么都没有。原子一直存在于宇宙之中,它们不能从无中被创生,也不能被消灭,任何变化都是它们引起的结合和分离。
经典力学
道尔顿实心球模型
经过两千余年的探索,后来许多科学家针对原子结构提出了自己的学说理论。把原子学说第一次从推测转变为科学概念的是英国科学家道尔顿。1803年,英国科学家道尔顿将古希腊思辨的原子论改造成定量的理论。提出了原子学说以及世界上第一个有关原子的理论模型。道尔顿认为所有物质都是由非常微小的、不可再分的物质微粒即原子组成;同种元素的原子的各种性质和质量都相同,不同元素的原子,主要表现为质量的不同;原子是微小的、不可再分的实心球体。原子是参加化学变化的最小单位,在化学反应中,原子仅仅是重新排列,而不会被创造或者消失。但道尔顿原子学说不能解释同位素的发现,没有说明原子和分子的区别,也未能阐释原子的具体组成和结构。
汤姆逊葡萄干布丁原子模型
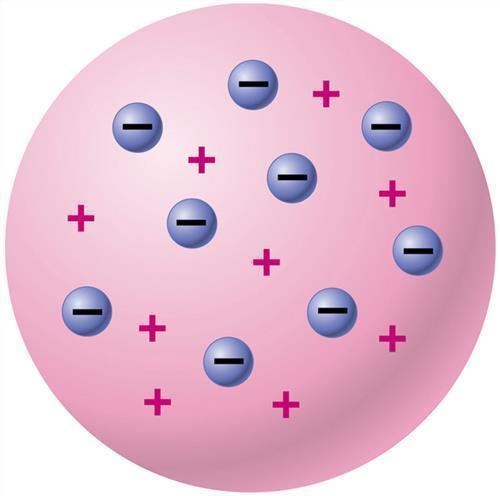
1897年,汤姆逊发现原子中存在电子,并用实验方法测出电子的质量不及氢原子质量的千分之一(后进一步确定为氢原子质量的1/1836)。电子的发现使人们对原子结构的认识进入新的阶段,认识到原子是由更小的微粒构成的。1901年,法国物理学家佩兰(Jean Baptiste Perrin)在一次演讲中提出一种原子结构模型,认为原子的中心是一些带正电的粒子,外面围绕着一些电子(带负电),电子运行的周期就对应于原子发射光谱谱线的频率。1902年,英国物理学家开尔文(Lord Kelvin)提出类似葡萄干布丁的原子模型,认为原子是一个半径大约为10米的球体,正电荷就均匀地分布于整个球体,电子则稀疏地嵌在球体中。1904年,汤姆逊在发现电子的基础上提出葡萄干布丁模型(枣糕模型)。认为正电荷像流体一样均匀分布在原子中。电子就像葡萄干一样散布在正电荷中,它们的负电荷与那些正电荷相互抵消;在受到激发时,电子会离开原子,产生阴极射线。同时期,日本物理学家长冈半太郎认为正负电不可能相互渗透,而提出了一种他称之为“土星型模型”的结构。在长冈的模型中,电子均匀地分布在一个环上,环的中心则是一个具有大质量的带正电的球。他还根据麦克斯韦关于土星环运动稳定性的研究,得出了他的模型中这种环的运动方程。但该模型后来被德国物理学家盖革(H. Geiger,1882-1945)和新西兰物理学家马斯登(E. Marsden,1880-1970)的实验否定了。
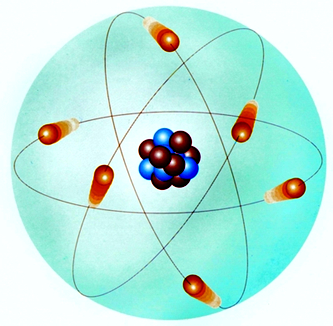
卢瑟福有核行星模型
1911年,卢瑟福以经典电磁学为基础,通过α粒子散射实验提出行星模型,即太阳系模型,也称有核模型。卢瑟福认为原子的大部分体积是空的;在原子的中心有一个体积很小、密度极大的原子核;原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部。带负电的电子在核外空间进行高速的绕核运动。
1913年,在卢瑟福指导下,盖革和马斯登又仔细进行了α粒子散射实验,证实了散射公式的正确性,从而支持了原子有核模型。卢瑟福提出的原子有核模型一开始并没引起重视,然而不久以后,卢瑟福的弟子玻尔大胆提出了核外电子定态和跃迁的革命性假说,圆满解释了氢光谱现象。
量子力学
玻尔原子轨道模型
1913年,玻尔将量子概念用到了卢瑟福的原子模型中,并且将原子结构与光谱联系起来,提出了玻尔的氢原子模型。1913年7月、9月、11月,经由卢瑟福推荐,《哲学杂志》接连刊载了玻尔的三篇论文,标志着玻尔模型正式提出。这三篇论文成为物理学史上的经典,被称为玻尔模型的“三部曲”,他在第一篇论文中着重阐述了有关辐射的发射和吸收,以及氢原子光谱的规律,在第二篇论文中论述了其它原子结构与周期表,在第三篇论文中探讨了分子结构。
玻尔-索末菲理论
1916年,索末菲和德拜各自独立地对氢原子模型进行了修正,形成了“玻尔-索末菲理论”。亦即将玻尔氢原子模型的圆形轨道推广到椭圆形轨道,并且相应地,将玻尔原先的量子化条件从1个扩展到3个。
薛定谔电子云模型
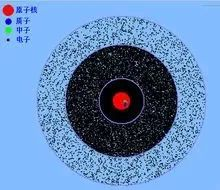
原子模型的真正量子力学描述,是在薛定谔建立了他的波动方程之后,被物理界所公认的电子云模型。1926年奥地利学者薛定谔提出了著名的薛定谔方程式。这个方程式的解,如果用三维坐标以图形表示的话,就是电子云。电子云是近代对电子用统计的方法,在核外空间分布方式的形象描绘,它的区别在于行星轨道式模型。电子有波粒二象性,它不像宏观物体的运动那样有确定的轨道,因此画不出它的运动轨迹。我们不能预言它在某一时刻究竟出现在核外空间的哪个地方,只能知道它在某处出现的机会有多少。为此,就以单位体积内电子出现几率,即几率密度大小,用小白点的疏密来表示。小白点密处表示电子出现的几率密度大,小白点疏处几率密度小,看上去好像一片带负电的云状物笼罩在原子核周围,因此叫电子云。薛定谔方程到目前为止通过了所有实验的考验,它是量子力学的基本方程,它是描述的每一个量子力学系统的出发点。薛定谔方程最早的成功在于它描绘了氢原子的离散能量谱。在玻尔的原子模型中,电子被限制在某些能量级上,薛定谔将他的方程用于氢原子,发现他的解精确的重现了玻尔的能量级。
相关原理
卢瑟福有核模型
α粒子散射实验的历史背景:汤姆逊原子模型被广泛接受和放射性的发现。卢瑟福散射的基本思想:α粒子被看作一带电质点,在核库仑场中的运动遵从经典运动方程;原子核的大小和原子相比是很小的,且原子核具有正电荷 Ze 和原子的大部分质量; 电子的质量很小,对α 粒子运动的影响可忽略不计。结果:绝大多数α粒子经过金属箔的散射后,只有很小角度的偏转,偏转角度小于2°;有大约1/8000的α粒子的散射角度大于90°。
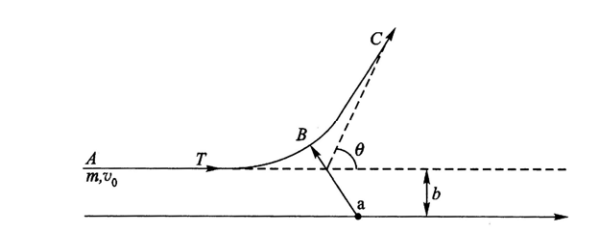
瞄准距离与散射角的关系
卢瑟福把α粒子和靶原子都当作点电荷,假设两者之间的静电斥力是唯一的相互作用 力。这是一个两体碰撞问题。设一个α 粒子以速度
卢瑟福微分散射截面
由散射角与瞄准距离的关系式(2)可见,瞄准距离b大,散射角θ 就小;反之,b小,θ就大。只要瞄准距离b足够小,θ就可以足够大,这就解释了大角度散射的可能性。但要从实验上来验证式(2),显然是不可能的,因为我们无法测量瞄准距离b 。然而我们可以求出α 粒子按瞄准距离b的分布,根据这种分布和式(2),就可以推出散射α粒子的角分布, 而这个角分布是可以直接测量的。
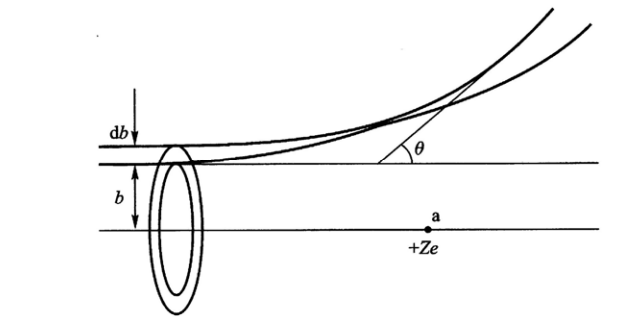
设有截面为S的α粒子束射到厚度为t的靶上。其中某一α粒子在通过靶时相对于靶中 某一原子核a的瞄准距离在b ~ b + db 之间的概率,应等于圆心在a而圆周半径分别为b 、b + db圆环面积与入射粒子截面S之比。若靶的原子密度为n ,则α粒子束所经过的这块体积内共有nSt个原子核,因此,该α粒子相对于靶中任一原子核的瞄准距离在b与b + db之间的概率为
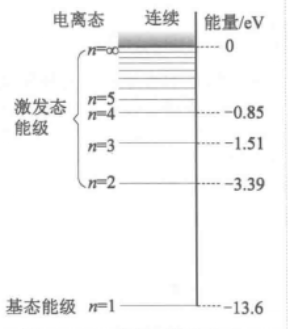
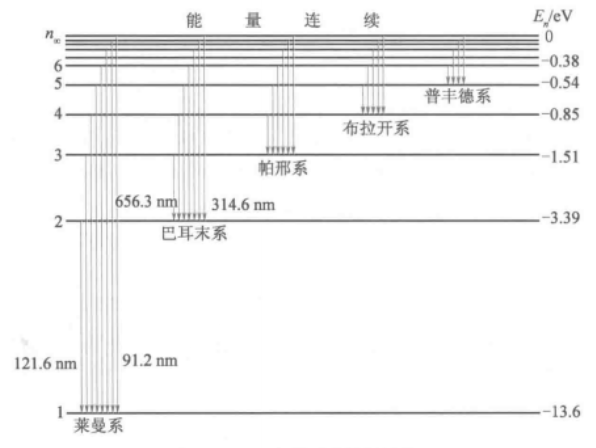
原子可以从较高能态向较低能态跃迁,并伴随光的发射。与n≥2的激发态向基态的跃迁相应的发射形成赖曼线系,由n≥3的激发态向n=2的跃迁相应的发射形成巴耳末线系。
轨道角动量量子化假设
玻尔发现,原子中电子绕核运动的轨道角动量L只能是
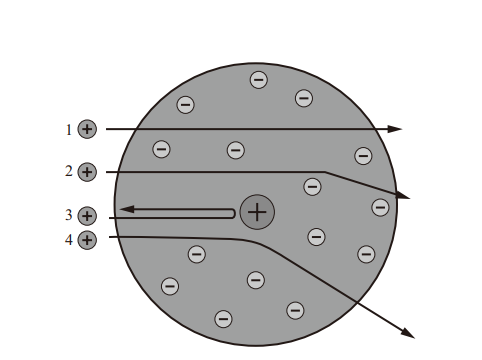
α粒子轰击氮原子核实验
卢瑟福被公认为质子的发现人。1918年,卢瑟福任卡文迪许实验室主任时,用α粒子轰击氮原子核,注意到在使用α粒子轰击氮气时他的闪光探测器纪录到氢核的迹象。卢瑟福认识到这些氢核唯一可能的来源是氮原子,因此氮原子必须含有氢核。他因此建议原子序数为1的氢原子核是一个基本粒子。在此之前尤金·戈尔德斯坦(Eugene Goldstein)就已经注意到阳极射线是由正离子组成的。但他没有能够分析这些离子的成分。卢瑟福发现质子以后,又预言了不带电的中子存在。
玻尔理论相关实验
皮克林线系的验证—类氢光谱
光谱线系的规律与原子结构有内在的联系,因此,光谱是研究原子结构的一种重要的方法。早在1885年瑞士物理学家约翰·雅各布·巴耳末(Johann Jakob Balmer)就发现了可见光区氢(H)光 谱谱线波长的规律,即巴尔末公式。这些谱线构成了一个谱线系,即巴尔末系,并用 Hα、Hβ、Hγ等字母代表巴尔末系的第一条、第二条、第三条谱线。1897年,美国天文学家皮克林(E.C.Pickering)在恒星弧矢增二十二的光谱中发现了一组独特的线系,称为皮克林线系。皮克林线系中有一些谱线靠近巴耳末线系,但又不完全重合,另外有一些谱线位于巴耳末线系两临近谱线之间。起初皮克林线系被认为是氢的谱线,然而玻尔提出皮克林线系是类氢离子He发出的谱线。随后英国物理学家埃万斯在实验室中观察了He的光谱,证实玻尔的判断完全正确。
莫斯莱公式验证
和玻尔提出玻尔模型几乎同一时期,英国物理学家亨利·莫斯莱(Henry Gwyn Jeffreys Moseley)测定了多种元素的X射线标识谱线,发现它们具有确定的规律性,并得到了经验公式—莫塞莱公式。莫塞莱看到玻尔的论文,立刻发现这个经验公式可以由玻尔模型导出,为玻尔模型提供了有力的证据。
夫兰克—赫兹实验
1914年,夫兰克(James Franck)和赫兹(Gustav Hertz)进行了用电子轰击汞蒸汽的实验,即夫兰克-赫兹实验。实验结果显示,汞原子内确实存在能量为4.9eV的量子态。1920年代,夫兰克和赫兹又继续改进实验装置,发现了汞原子内部更多的量子态,有力地证实了玻尔模型的正确性。
普朗克辐射定律
1916年,爱因斯坦从玻尔的原子理论出发用统计的方法分析了物质的吸收和发射辐射的过程,导出了普朗克辐射定律。爱因斯坦的这一工作综合了量子论第一阶段的成就,把普朗克、爱因斯坦、玻尔三人的工作结合成一个整体。
氘存在验证
1932年,美国物理学、化学家哈罗德·克莱顿·尤里(Harold Clayton Urey)发现氢(H)的同位素—氘(D)的光谱,测量到了氘的里德伯常数,和玻尔模型的预言符合得很好。
查德威克实验-发现中子
1932年,查德威克(J. Chadwick) 在约里奥-居里夫妇(F. Joliot-Curie and I. Joliot-Curie)工作的基础上通过进一步的实验,发现了中子。约里奥-居里夫妇用铍射线轰击石蜡和其他含氢物质,观察到石蜡中放射出一种强粒子流。由于当时人们错误地认为这种铍辐射是一种辐射,从而对这种粒子流的放射现象难以做出解释。查德威克根据约里奥-居里夫妇的实验,敏锐地觉察到铍辐射绝不是γ辐射,很可能是由铍中射出的新的粒子组成的。进而,他在用ɑ粒子轰击核的实验中发现了中子。中子的发现使人类对物质结构的认识从原子核深入到质子 (p)、中子 (n) 这一层次。此后,海森堡 (W. K. Heisenberg) 和伊凡宁柯 (D. Iwanenko) 立即提出了原子核由质子和中子组成的假说。不久,这一假说获得验证。至此人们认识到,原子是由原子核和绕核运动的电子组成的,而原子核由质子和中子通过很强的相互作用结合而成。氢原子是最简单的原子,它的原子核仅有一个质子。除了氢原子核外,所有原子核中,带正电荷的质子的质量和都比原子核质量要轻。由带正电的质子和不带电的中子组成的原子核带正电,带负电的电子由于电磁相互作用束缚在原子核周围,从而形成原子。

意义
英国科学家道尔顿的实心球模型将原子学说第一次从推测转变为科学概念,而电子的发现从实验上打开了进入微观世界的大门,从而也开启了原子物理、原子核物理和基本粒子物理学的新时代。随后原子有核结构的发现宣告了原子核物理学的诞生,原子核物理学是研究原子核性质的物理学分支。其三大领域,即研究各类次原子粒子与它们之间的关系、分类与分析原子核的结构、带动相应的核子技术进展。玻尔的核外电子定态和跃迁的革命性假说,圆满解释了氢光谱现象。其次,解释了巴耳末与里德伯的公式,首次算出了里德伯常量。理论中关于原子能量量子化,基态和激发态及量子跃迁等基本概念迄今仍然沿用。该理论的提出一方面对旧量子论做出了贡献,另一方面也率领了根本哈根学派完成了量子力学的根本哈根诠释,并影响了当时的众多物理学家,加速了量子论的发展。玻尔理论虽然取得了巨大的成功,但在物质和辐射的相互作用问题上却带有神秘的成分。第一个向这个黑暗的角落投射光明的是爱因斯坦。他于1916年从玻尔的原子结构理论出发,研究了分子的吸收和发射辐射过程,把发射过程分成自发发射和受激发射,然后用统计方法来分析这两种过程,结果就非常方便地推导出普朗克辐射定律。而如果略去受激辐射,就得到了维恩的辐射定律。爱因斯坦这一工作,综合了量子论在第一阶段的成就,而且第一次提出了受激辐射理论。60年代蓬勃发展起来的激光技术,就是以这一理论为基础。薛定谔方程是量子力学的唯一动力学方程。它的出现,解决了令人头疼的原子能级问题,并用来解决几乎所有涉及微观粒子的问题。
应用
分析原子能级跃迁辐射
由于原子轨道是分立的,则原子的能量也是分立的,即量子化的。这些量子化的能量被称为能级。当原子从一个具有较大能量En的定态跃迁(transition)到另一个具有较低能量En定态时,原子辐射一个光子,光子的频率满足
解释元素周期表的性质
1869年3月1日,俄国化学家门捷列夫(Dmitri Mendeleev)总结发表第一代元素周期表(periodic table of the elements)。元素周期表是周期律的表现形式。元素周期律的发现,证明各种化学元素、各种不同原子之间并不是彼此孤立,而是有深刻的内在联系。原子结构理论的形成深刻揭示了周期律的内在因素。第一个对周期表给予物理解释的是玻尔,他在1916年至1918年期间把元素按电子组态的周期性排列成表,假定原子可以认为是电子被逐个俘获并被束缚而建立起来的。猜测原子的每一个定态轨道上只能容纳有限个电子,并准确预言了72号元素的存在,并预测了它的性质,有效地解释了化学元素周期表的意义。在接下来的一些列实验中,科学家们进行了深入的量子化学研究,解决了核外电子运动状态的描述和核外电子的排布问题,从而真正解释了元素性质的周期性变化,即由于元素的原子的电子层结构有周期性变化导致元素性质的周期性变化。