简介
仑卡奈单抗有500mg/5ml和200mg/2ml2种规格。推荐剂量为10mg/kg,使用前需用250ml氯化钠注射液稀释,输注前稀释液应放至室温。约在1h内完成静脉输注,每2周给药1次。常见的副作用是头痛、淀粉样蛋白相关的脑部成像异常和输液相关反应如呼吸困难和低血压等。
2023年7月6日仑卡奈单抗取得美国FDA(美国食品药品监督管理局)的完全批准。仑卡奈单抗是20年来首个获得FDA完全批准的阿尔茨海默病药物。2024年1月9日,仑卡奈单抗在中国获批。
医学用途
适应证
仑卡奈单抗是一种针对淀粉样蛋白β的抗体,用于治疗阿尔茨海默氏病。仑卡奈单抗治疗应在轻度认知障碍或轻度痴呆阶段的患者中开始。
用法与用量
在开始治疗前,确认淀粉样蛋白β病理的存在。
推荐的剂量是10 mg/kg,必须稀释,然后以大约1小时的静脉输液形式给药,每两周一次。
在开始治疗前获取近期(一年内)的脑部MRI,以评估预先存在的淀粉样蛋白相关影像异常(ARIA)。
在第5、7和14次输液前获取MRI。如果观察到ARIA,则根据类型、严重程度和是否存在症状进行治疗建议。
在给药前需要稀释在250 mL的0.9%氯化钠注射液中。
以大约1小时的静脉输液形式通过终端低蛋白结合0.2微米的内联过滤器给药。
制剂与规格
仑卡奈单抗是一种透明至乳白色和无色至淡黄色的溶液,可用作注射剂500mg/5mL (100mg/mL) 的单剂量小瓶和200mg/2mL (100mg/mL) 的单剂量小瓶2种规格。
药理机制
仑卡奈单抗是一种针对聚集的可溶性和不溶性淀粉样β蛋白的人源化免疫球蛋白γ1(IgG1)单克隆抗体。脑中淀粉样β蛋白斑块的积聚是阿尔茨海默病的明确病理生理特征,仑卡奈单抗可减少淀粉样β蛋白斑块。
药代动力学
一项仑卡奈单抗的单剂量爬坡试验(NCT01230853)表明,仑卡奈单抗血药峰浓度(Cmax)和血药浓度-时间曲线下面积(area under the curve,AUC)在0.3~15mg/kg剂量下成比例增加。10mg/kg单剂量下,平均Cmax为264μg/ml,平均AUC0~24h为5010μg·h/ml,平均半衰期(t1/2)为165h;相同剂量且每2周给药1次的多剂量试验下,第6周后达到稳态血药浓度,最后1剂给药后受试者的Cmax为307μg/ml,AUC0~24h为5720μg·h/ml,平均t1/2为127h,此时中央分布容积为3.22L。仑卡奈单抗的清除率为0.434L/d,终末半衰期为5~7d。
仑卡奈单抗与内源性IgG的消除途径相同,均被蛋白水解酶降解。暂未在肾功能不全或肝功能不全的受试者体内开展仑卡奈单抗药动学研究,但基于其消除原理,理论上其不会经肾脏消除或经肝脏代谢。
风险与禁忌
不良反应
最常见的不良反应(与安慰剂相比,发生率大约为10%或更高):输液相关反应、头痛和ARIA-脑水肿。
淀粉样蛋白相关影像异常(ARIA):建议在LEQEMBI治疗的前14周内加强对ARIA的临床警惕。与杂合子和非携带者相比,载脂蛋白E ε4纯合子患者的ARIA风险(包括症状性ARIA)增加。如果患者出现ARIA症状,应进行临床评估,包括MRI扫描(如需要)。
输液相关反应:输液速度可能会降低,或者输液可能会中断,并根据临床指示进行适当的治疗。考虑在随后的剂量给药前服用抗组胺药、非甾体抗炎药或糖皮质激素进行预处理。
特殊人群用药
妊娠期
截至尚无足够的数据来评估仑卡奈单抗在孕妇中的使用与重大出生缺陷、流产或其他不良母体或胎儿结局相关的风险。尚未进行动物研究来评估仑卡奈单抗的潜在生殖或发育毒性。在美国普通人群中,临床公认的妊娠中重大出生缺陷和流产的估计背景风险分别为2%至4%和15%至20%。指定人群中重大出生缺陷和流产的背景风险尚不清楚。
哺乳期妇女
哺乳风险总结尚无关于乳清蛋白-irmb在母乳中存在、对母乳喂养婴儿的影响或药物对产奶量的影响的数据。其他单克隆抗体公布的数据通常表明单克隆抗体进入母乳的途径较低,母乳喂养婴儿的全身暴露有限。这种有限暴露的影响尚不清楚。母乳喂养对发育和健康的好处应与母亲对仑卡奈单抗的临床需求以及仑卡奈单抗或潜在的母亲状况对母乳喂养婴儿的任何潜在不利影响一起考虑。
老年人
老年用药研究中,由于仑卡奈单抗临床研究中年龄小于65岁和80岁及以上的患者数量较少,因此与年龄相关的临床疗效和安全性发现受到限制。
儿童
仑卡奈单抗在儿科患者中的安全性和有效性尚未确定。
临床数据
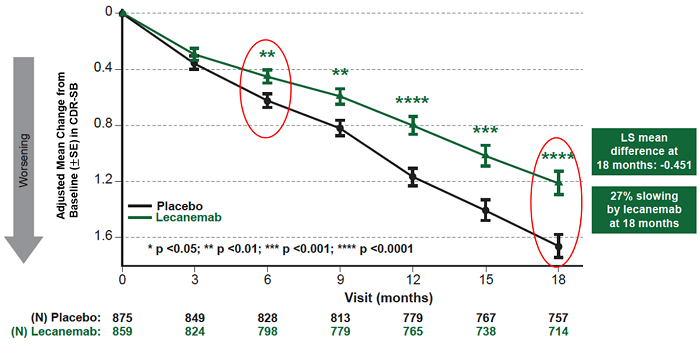
仑卡奈单抗的III期临床试验在1795名阿尔茨海默早期患者中进行,发现在18个月的治疗中,仑卡奈单抗治疗组与安慰剂组相比患者认知衰退幅度减缓27%。
仑卡奈单抗组和安慰剂组治疗18个月后,主要终点CDR-SB较基线的平均变化分别为1.21和1.66分。仑卡奈单抗治疗18个月较安慰剂显著改降低体认知与功能量表评分0.45分(95%置信区间(CI):-0.67~ -0.23; P=0.00005),降幅达27%。从治疗6个月开始的所有时间点,治疗组较安慰剂组的绝对差每3个月增加1次,治疗组的CDR-SB较基线有高度统计学显著差异(所有p值均<0.01)。
仑卡奈单抗治疗组最常见的不良事件(>10%)是注射部位反应(仑卡奈单抗:26.4%;安慰剂:7.4%)、ARIA-H(合并脑微出血、大量脑出血和表面铁沉积症; 仑卡奈单抗:17.3%;安慰剂:9.0%)、ARIA-E(水肿/渗出性改变; 仑卡奈单抗:12.6%;安慰剂:1.7%)、头疼(仑卡奈单抗:11.1%;安慰剂:8.1%)以及跌倒(仑卡奈单抗:10.4%;安慰剂:9.6%)。注射部位反应绝大部分为轻中度(1~2级:96%),且主要发生于首次给药时(75%)。
在18个月的双盲试验期间,仑卡奈单抗组和安慰剂的死亡率分别为0.7%和0.8%,没有发现与仑卡奈单抗治疗或淀粉样蛋白相关的影像学异常(ARIA)相关的死亡。分别有14%和11.3%的仑卡奈单抗治疗组与安慰剂组的患者发现严重不良事件。治疗组与安慰剂组治疗期间报告的不良事件(TEAE)发生率分别为88.9%和81.9%,TEAE所致治疗组与安慰剂组的停药率分别为6.9%和2.9%。
总体上,根据 II 期试验结果,仑卡奈单抗的ARIA发病率符合预期范围。在卫材的验证性Ⅲ期研究Clarity AD中,仑卡奈单抗在不同认知和功能量表以及亚组(人种、民族、合并症)之间证实了结果的一致性。根据CDR评估,仑卡奈单抗治疗使疾病进展位下一阶段的风险降低了31%(风险比:0.69)。基于观察到的数据和外推至30个月的CDR-SB进行的斜率分析表明,仑卡奈单抗治疗25.5个月相当于安慰剂18个月时的水平,这表明仑卡奈单抗可以延缓疾病进展达7.5个月。
使用情况
2022年3月,卫材开始在事前评估咨询系统下向日本药品和医疗器械局(PMDA)提交除Clarity AD数据外的申请,目的是尽早获得仑卡奈单抗的批准,以便早期AD患者可能会尽快接受治疗。同年7月,美国食品药品监督管理局(Food and Drug Administration, FDA)受理了卫材仑卡奈单抗在快速通道认定下的生物制品许可申请(BLA),并授予优先审查权。
日本卫材公司2023年1月11日发布消息称,已向欧洲药品管理局申请批准销售该公司与美国渤健共同研发的阿尔茨海默病治疗新药“仑卡奈单抗”(Lecanemab)。该药1月6日在美国获得了政府的快速批准。7月6日,美国食品药品监督管理局(FDA)官网发布消息称,卫材/渤健联合开发的仑卡奈单抗用于治疗阿尔茨海默病(AD)的加速批准成功转为完全批准,该药是20年来首个获得FDA完全批准的阿尔茨海默病药物。
日本厚生劳动省的专门小组会2023年8月21日批准了日本制药巨头卫材和美国渤健共同开发的阿尔茨海默病治疗药仑卡奈单抗的制造和销售。同年9月在日本获得批准上市。
在中国,卫材于2022年10月向国家药品监督管理局提交仑卡奈单抗的上市申请。2024年1月9日仑卡奈单抗在中国获批上市,中国是第三个批准仑卡奈单抗上市的国家。