相关历史
中国古代劳动人民在腌制肉类食品时就使用了硝石(硝酸钾),这一处理的应用,对肉制品的生产发展起了一定的作用。硝酸钾与来自海水里的盐不同,它是由风化产物在穴壁或潮湿墙壁下部结壳而形成的一种盐。早在远古时代,人们便注意到它的存在,公元前3世纪苏美尔人的碑文中便有关于它的记载。7世纪,中国就有用焰硝(硝酸钾)、硫黄和木炭做火药。在中世纪时期,冷却食物是通过在水中加入某种化学物质如硝酸钠或硝酸钾,而使温度降低,1550年记载的冷却酒就是通过这种方法制作的,这就是制冷工艺的起源。
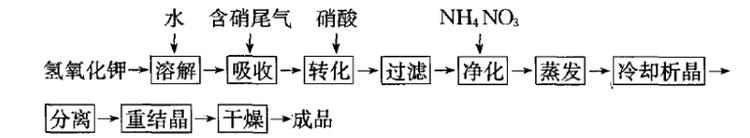
在1914-1918年世界大战期间,德国无法从智利进口硝石,因此只能寻找其他方法合成硝酸钾,德国化学家奥斯特瓦尔德(Ostwald)和其他有关专家一起,成功地在铂催化条件下用氢气和氮气为原料合成氨,并通过氨氧化法制取了硝酸,然后再以硝酸和氯化钾反应制得硝酸钾,从而结束了德国进口智利硝石的历史。
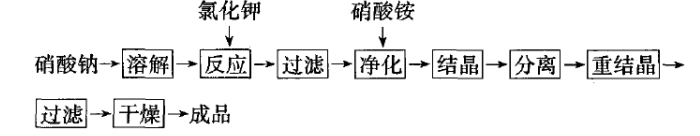
在自然界中没有储量大的硝酸钾矿,早在中世纪,中国就已从含硝堆肥中获得硝酸钾以制造黑色火药。在19世纪60年代以前,用硝酸钠(智利硝石)等与氯化钾复分解反应来制取硝酸钾。因产品价格较高,主要应用于工业。在60年代以后硝酸与氯化钾反应生产硝酸钾的直接法流程开发成功,美国西南钾碱公司于1963年投产,以色列IMI于1969年投产。到了80年代智利SQM厂 (Sociedad QuimicaY Minera De Chile SA,智利化工、矿业公司)以智利硝石生产硝酸钾,改进了生产工艺,降低了成本,1990年SQM厂年产硝酸钾180 kt。
理化性质
物理性质
硝酸钾常温下为白色颗粒状或结晶状粉末,无臭有毒,有盐水刺激性味道,具有弱吸湿性,摩尔质量为101.103 g/mol,在标准大气压下沸点为400 ℃,熔点为333~334 ℃,在常温下密度为2.1 g/cm。硝酸钾易溶于水并且在水中的溶解度随温度升高而增加(在20 ℃时的溶解度为31.6 g/100 g;在80 ℃时的溶解度为246.0 g/100 g),能溶于液氮和丙三醇,微溶于酒精,不溶于乙醇。

硝酸钾在水中溶解度温度 ℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度,g/100 g 水 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | 169.0 | 246.0 |
化学性质
硝酸钾是很强的氧化剂,高温下受热会分解产生亚硝酸钾和氧气,与热源、还原剂接触有燃烧爆炸的危险。
氧化还原反应
硝酸钾是强氧化剂。黑火药反应(“一硝二硫三木炭”)就是利用了硝酸钾的强氧化性,该反应中硫和硝酸钾都是氧化剂,反应过程会放出大量的热,热量使反应产物气体体积膨胀到比原来固体体积大一千倍以上,最终产生爆炸。反应方程式如下:
硝酸法
硝酸与氯化钾在较低的温度下,直接生成硝酸钾。
分子结构
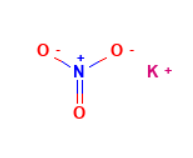
硝酸钾是多键型化合物,不仅有带极性的N-O共价键,还有金属钾离子和硝酸根离子之间的离子键。
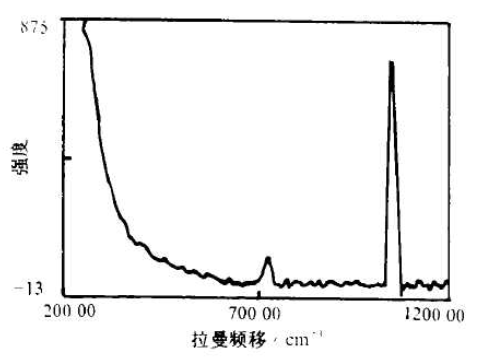
硝酸钾晶体结构在室温下属于正交晶系,又称斜方晶系,属低极晶族,外观为针状、粒状或毛发状的集合体。三结晶轴均不等长,互相垂直,即其晶胞参数具有a≠b≠c,α=β=y=90°的特征。其中硝酸根阴离子的几何形状是一个平面三角形,氧原子在三角形的顶点,每个氧原子带负电荷,氮原子位于三角形中心,带正电荷。硝酸钾的拉曼光谱特征峰在1055 cm⁻¹和722 cm⁻¹左右。
安全事宜
毒性
毒性:大鼠经口LD50为3.2 g/kg。FAO(联合国粮食及农业组织)和WHO(世界卫生组织)1994年规定,ADI值为0~5 mg/kg(以硝酸钠计的硝酸盐总量),在硝酸盐中,硝酸钾的毒性较强,此外其所含的钾离子对人体心脏有影响。
健康危害
如果吸入硝酸钾粉末,会引发咳嗽、呼吸急促和喉咙痛等症状,吸入过高浓度的硝酸钾粉末会引起肺部疾病。
如果摄入硝酸钾,可能引起肠胃不适,引发恶心、腹痛、呼吸困难、精神错乱呕吐和腹泻等症状。大量摄入可能致死,成年人的硝酸钾致死剂量为54 mg/kg~462 mg/kg。需要在医生指导下使用。
如果皮肤接触硝酸钾,可能导致皮肤发红、瘙痒、疼痛、干燥和皮疹,甚至灼伤皮肤,大量接触可能引起高铁血红蛋白血症。硝酸盐的主要急性毒性作用是导致高铁血红蛋白血症,在这种情况下,体内超过 10% 的血红蛋白转化为高铁血红蛋白。当这种转化超过 70% 时,可能会导致死亡。
急救措施
当不慎吸入硝酸钾,需要立即将人移至空气清新处休息。转诊就医。若皮肤接触硝酸钾,需立即脱掉被污染的衣服。冲洗,然后用水和肥皂清洗皮肤。食入硝酸钾需立即漱口,然后转诊就医。
防护措施
在操作时,要密闭操作,加强通风,通风系统优选局部排气通风,以使员工的暴露程度尽可能低,局部排气通风还可以防止硝酸钾分散到其他工作区域。操作人员不得佩戴隐形眼镜,必须穿聚乙烯防毒服,戴氯丁橡胶手套。硝酸钾车间应该远离可燃物、火种和热源,在工作场所不能吸烟、吃东西以及喝水,离开工作场所要脱掉与硝酸钾接触的衣物。
消防措施
硝酸钾自身在常温下不可燃烧,但它是一种强的氧化剂,在高温受热下会释放出氧气,因此与还原剂、有机物或可燃物接触会引发燃烧甚至爆炸,遇到可燃物着火时还会助长火势。硝酸钾受热分解还会产生有毒的氮氧化合物。
消防人员必须佩戴防毒面具、穿全套消防服,在上风向灭火。需持续喷水直至火场容器冷却,切勿将水流直接射至燃烧物,以避免引起严重的流淌火灾或者引起火星剧烈的沸溅。
应急处理
如果出现硝酸钾固体粉末少量倾洒的情况,要立即使用工具将倾洒的硝酸钾收集到专用的容器中,然后把容器转移出倾洒区。
如果出现硝酸钾液体少量溢出的情况,要立即使用蛭石砂或沙子来吸收产品,并将吸收后的混合物收集到密闭容器。
如果出现硝酸钾液体大量溢出的情况,要立即筑堤进行处理。
贮存注意事项
硝酸钾是强氧化剂,因此在贮存和运输时要远离火种、热源、还原剂、可燃物和活性金属粉末。贮存于阴凉干燥处,并且保持良好的通风条件,贮存温度不超过30 ℃,相对湿度不超过80 %,避免产生粉尘以及硝酸钾结块。倒空的容器可能残留硝酸钾,因此要妥善处理。













