历史
古希腊时代,哲学家亚里士多德(Aristotle)曾记录了燃烧的煤炭会散发有毒烟气的现象。当时有一种执行死刑的方法,将罪犯关在一间浴室,并在浴室内放置文火燃烧的煤炭。古希腊医生盖伦(Galen)推测,可能是浴室内空气的组成发生了变化,因此呼入后能引起伤害。
1630年,比利时化学家扬·巴普蒂斯塔·范·海尔蒙特( Johann Baptist van Helmont)在实验中研究了许多气体,其中碳气是指燃烧木炭和其他可燃物生成的气体,通常是二氧化碳,但有时也是一氧化碳,因为扬·巴普蒂斯塔·范·海尔蒙特说在他65岁时差点被燃烧的木炭的烟熏死,而他记述的是一氧化碳中毒的症状。扬·巴普蒂斯塔·范·海尔蒙特发现由文火燃烧的木炭产生的一种有毒气体,这种气体能危及自己的生命。另外,他发现有机物腐烂或在缺氧状态下加热产生的气体,相当轻而且可以燃烧。
1776年,法国化学家拉松(DeLassone)通过让焦炭加热氧化锌以及加热枪管中的普鲁士蓝得到一氧化碳。他在《皇家科学院备忘录》中把这种气体描述为“一种性质极怪异的可燃空气”。1785年,英国科学家普里斯特利(J.Priestley)用木炭加热铸皮,制备了一氧化碳;但他误以为它是“可燃空气”。
早期的研究者认为,一氧化碳是一种碳和氢的化合物。1800年W.Cruikshank在一氧化碳的燃烧产物中没有检测出水,证明一氧化碳中不含氢。1801年~1802年,N.Clement和C.B.Desormes合作,精确地测定了一氧化碳的化学组成。1877年Cailletet制得液体CO。1885年Von Wroblewsky首次使CO固化。在第二次世界大战期间,德国把CO用作合成烃类燃料的主要原料。
来源
自然与人为
所有含碳燃料的不完全燃烧都会产生一氧化碳。在自然条件下,植物代谢或海洋和野火产生的一氧化碳释放进入大气。在自然条件下或人为情况下,甲烷和非甲烷碳氢化合物与轻自由基和臭氧产生氧化反应,也是大气中一氧化碳的一种来源。人类活动产生一氧化碳的主要来源于内燃机、天然气、石油、木材和固体废弃物。吸烟和排气炉不完全燃烧也可导致密闭空间内一氧化碳的聚积。
人体产生
人体内存在着多个合成并释放CO的生理代谢途径,其中依赖于还原型辅酶-Ⅱ(NADPH)的血红素加氧酶所催化的亚铁血红素分解生成CO是最主要的途径。血红素加氧酶存在三种同工酶:血红素加氧酶-1(HO-1)属于诱导型,可被内毒素、低氧和氧化剂等诱导。HO-1广泛分布于脾脏、肝脏和骨髓等代谢活跃的器官,对诱导刺激都十分敏感。血红素加氧酶-2(HO-2)和血红素加氧酶-3(HO-3)为结构型,是细胞生理状态下的主要存在形式。HO-2主要分布于脑内,在血管平滑肌和内皮细胞中也有表达,肾上腺糖皮质激素可上调HO-2的表达。HO-3主要分布于脾脏和肝脏等,其作用可能是调节依赖血红素的基因表达,但活性较低。生理条件下,人体每小时生成的CO接近20mmol,体内生成的CO大部分通过呼吸作用排出体外。
毒性
中毒机理
血红蛋白(Hb)中的二价铁离子的空轨道可以接受氧气分子提供的电子对形成氧合血红蛋白(HbO2),从而通过血液的流动运输氧气分子。一氧化碳可以作为配体与血红蛋白形成一氧化碳血红蛋白(HbCO)。一氧化碳血红蛋白比氧合血红蛋白稳定,因此,一氧化碳能把氧气从氧合血红蛋白中置换出来。
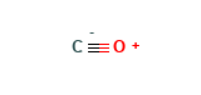
分子轨道理论解释
C原子核外有4个价电子,其电子结构式为2s2p;氧原子核外有6个价电子,其电子结构式为2s2p。由于碳原子和氧原子的相应原子轨道能量很近,因此互相重叠形成CO分子的分子轨道。一氧化碳的分子轨道式为:


| 
| GHS分类
GHS | 危险说明 | 危险等级 |
H220 | 极易燃气体 | 易燃气体 |
H331 | 吸入有毒 | 急性毒性,吸入 |
H360D | 可能会损害未出生的孩子 | 生殖毒性 |
H372 | 长期或反复接触会对器官造成损害 | 特定靶器官毒性,反复暴露 |
泄露与消防
当一氧化碳发生泄露与火灾时,人员需撤离至上风处,并立即隔离150m。切断火源时,应急处理人员需戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源,合理通风,加速扩散,喷雾状水稀释、溶解,构筑围堤或挖坑收容产生的大量废水。将漏出气用排风机送至空旷地方或用管路导至炉中、凹地梵之。漏气容器要处理,修复、检验后再用。切断气源。若不能立即切断气源,则不允许熄灭正在燃烧的气体。喷水冷却容器,可能的话将容器从火场移至空旷处。灭火剂:雾状水、泡沫、二氧化碳、干粉。

急救措施
将病人移到空气新鲜的地方,松解衣服。对呼吸心跳停止者立即行人工呼吸和胸外心脏按压,并肌内注射呼吸兴奋药,洛贝林或二甲弗林等,同时给氧。昏迷者针刺人中、十宣、涌泉等穴。病人自主呼吸、心跳恢复后方可送医院。