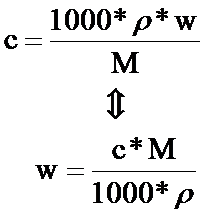物质的量是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度(单位:m)、质量(单位:kg)、时间(单位:s)、电流强度(单位:A)、发光强度(单位:cd)、温度(单位:K)、物质的量(单位:mol),它和“长度”,“质量”,“时间”等概念一样,是一个物理量的整体名词。其符号为n,单位为摩尔(mol),简称摩。物质的量是表示物质所含微粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。阿伏伽德罗常数的数值约为0.012kg ¹²C所含碳原子的个数,为6.02214076×10²³。它是把一定数目的微观粒子与可称量的宏观物质联系起来的一种物理量。物质的量是一个物理量,它表示含有一定数目粒子的集体,符号为n。物质的量的单位为摩尔,简称摩,符号为mol。国际上规定,1mol为精确包含6.02214076×10^23个原子或分子等基本单元的系统的物质的量。
本页面主要目录有关于物质的量的:基本符号、常数关系、相关公式等介绍