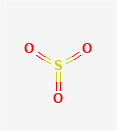
理化性质
物理性质
三氧化硫是一种无色固体或油状液体。三氧化硫有三种同素异形体,α-SO₃的晶体与冰的结构相似,熔点为62.3℃,在25℃下蒸汽压为9731Pa;β-SO₃常温下石棉状针状结晶,熔点为32.5℃,在25℃下蒸汽压为4.59×10⁴Pa;γ-SO₃常温下为油状液体,熔点为16.8℃,沸点为44.8℃,在25℃下蒸汽压为5.77×10Pa。自然条件下,三氧化硫通常是三种同素异形体不同比例的混合体,熔点不固定,密度1.97g/cm³,易升华。
化学性质
遇水成硫酸
三氧化硫极易与水反应产生硫酸,同时放出大量的热,反应方程式如下:
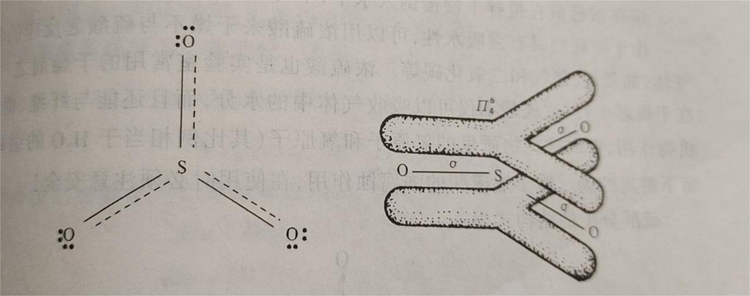
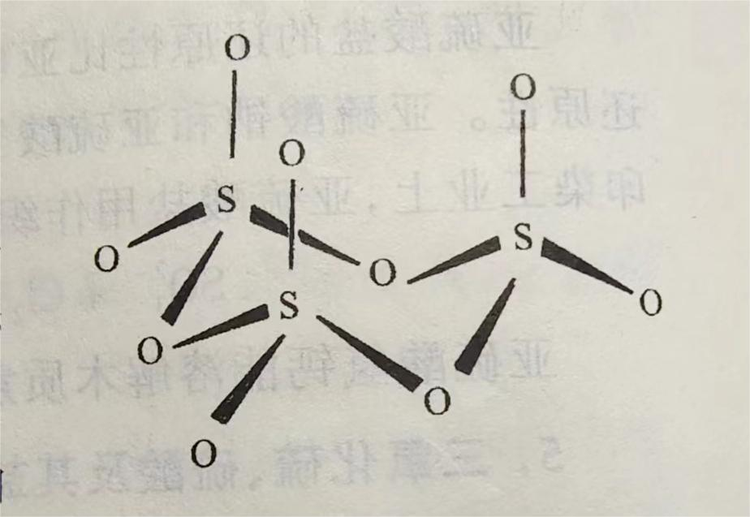
SO₃固体存在α、β、γ三种同素异形体。其中α-SO₃的晶体与冰的结构相似,为SO₃的三聚分子;β-SO₃为石棉状针状晶体;γ-SO₃为正交系结晶或液体,是(SO₃)₃形成的环状结构,固态时硫原子采取sp³轨道杂化成SO4四面体,三个这样的四面体通过共用氧而成环。γ-SO₃的晶体结构见下图。液态SO₃主要是以三聚分子形式存在。
检测方法
槲皮素比色法
槲皮素比色法适用于空气中的三氧化硫的检测。其原理是在酸性乙醇溶液中钍盐和槲皮素会形成黄色的络合物,这种络合物遇到硫酸会生成无色络合物,使溶液黄色消退,根据其颜色变化来比色定量。该方法用硫酸钾配成硫酸的标准溶液,用皂素溶液做吸收液,用硝酸钍溶液和槲皮素的乙醇溶液做显色剂,用盐酸调PH值。检测时先让吸收液充分吸收空气中三氧化硫,然后和配置成不同浓度的标准液一起显色。充分显色后,在分光光度计上比色定量。
氯化钡比浊法
本方法适用于空气中雾态三氧化硫的检测。其原理是将空气中的三氧化硫用微孔滤膜采集,用氯化钡充分析出后,测量吸光度,进行定量。用硫酸钾配制硫酸标准溶液,用氯化钡和盐酸配氯化钡溶液。检测步骤是将吸收了空气的微孔滤膜浸出后,溶液用配好的氯化钡溶液显色,对照空白试剂和配制好的硫酸溶液,可根据吸光度定量分析。
重量法
本方法适用于水泥中三氧化硫成分的测定,其原理是在酸性溶液中用氯化钡沉淀硫酸盐,经过滤灼烧后称量,以三氧化硫的形式计测定结果。检测要点是:1、往干燥烧饼中加样品和水以后要快速搅拌,使样品完全分散,防止结块。2、准确量取盐酸,控制好酸度。这样可以使硫酸钡完全沉淀,消除共沉淀状态。3、滴加氯化钡溶液速度不要太快,防止生成可以透过滤纸的小颗粒沉淀。4、加入氯化钡溶液后应确保沉淀完全且沉淀颗粒较大。5、滤纸要灰化完全,防止硫酸钡反应成碳酸钡,影响检测结果。6、要严格控制灼烧温度,温度过高,硫酸钡分解。