发现历史
人类对于臭氧最早的认识来源于1785年,当时荷兰科学家马丁努斯 ·马伦(Martinus van Marum)注意到一个现象,每当在进行放电实验时,就会出现一种特殊的气味,由于这种气味与自然界电闪雷鸣时产生的气味类似,他将其同样归因于放电反应,没有意识到他实际上已经创造了臭氧。
1840年,德国化学家克里斯蒂安·弗里德里希·舍恩拜因(Christian Friedrich Schönbein)证实了这种刺激性气味来自一种气体,这种气体是由氧气通电产生的。他将这种带有异味的气体正式命名为臭氧 。这个词来自希腊语的OZEIN(ὄζειν),原意是 "臭味"。
1858年,科学家们在地球的大气层中发现了臭氧成分,这是臭氧首次被证实在自然界中同样存在。
1857年,德国发明家维尔纳·冯·西门子(Ernst Werner von Siemens)发明了一种“超级感应管”,这种管能够产生臭氧,极大地方便了人们对臭氧性质的研究。
1866年,瑞士科学家雅克-路易·索雷(Jacques-Louis Soret)通过臭氧和氮氧化合物发生反应后生成物的体积变化,测定出臭氧和氧气的密度比为1.5:1。
第一次世界大战期间,德国医生将臭氧用于士兵战伤的治疗,这是臭氧用于临床的源头。
分布情况
臭氧是地球上早已经存在的自然物质,普遍存在于地球大气层中,但不同的高度的含量差异较大。臭氧主要分布在距地球表面10~50公里的平流层里,占大气中臭氧总量的90%。其中,在大约20—25公里处,臭氧的含量达到极值,该高度范围也被称为臭氧层。臭氧在大气中的含量非常少,在平流层中也仅占大气总量的0.3%,即使在臭氧层,浓度也仅为0.2ppm。随着环境的恶化,臭氧含量逐渐下降,臭氧层也面临着被破坏的风险。
臭氧也广泛存在于人类的生产实践中,主要作用是杀菌消毒,用于自来水消毒、食品加工保鲜等领域,此外,臭氧也应用于工业生产,医疗卫生等行业中。
O3分子结构
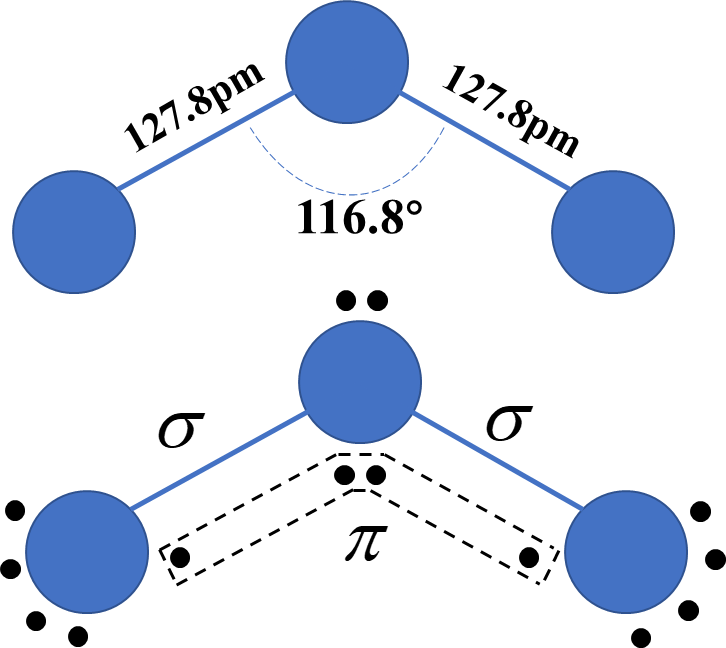
O3由三个氧原子构成,分子形状为折线型,呈等腰三角形结构(类似于水分子)。如右图上半图所示,三个氧原子分别位于三角形的顶点,键角为116.8°,中键长127.8pm,中间的氧原子采取sp杂化的形式与两端原子结合,氧原子的最外层有六个电子,其中,有两个单电子与两端的氧原子形成两个
理化性质
物理性质
常温常压下,臭氧为浅蓝色气体,具有刺激性气味,其摩尔质量为47.977g/mol,密度为2.144mg/cm(在0°C时),沸点为−112℃,熔点为-192.2℃。臭氧略溶于水,其溶解度是氧的13 倍,空气的25倍。 臭氧的液态呈深蓝色,固体为紫黑色。臭氧具有弱顺磁性。
名称及状态 | 标准电极电位 (mv) |
氟(气态) | 2.87 |
臭氧(气态) | 2.07 |
过氧化氢 | 1.78 |
高锰酸钾 | 1.67 |
二氧化氯 | 1.50 |
氯(气态) | 1.36 |
氧(气态) | 1.23 |
资料来源于: |
化学性质
无机反应
臭氧是已知最强大的氧化剂之一,如上表所示,臭氧的氧化性仅次于氟,远远强于O2。它在高浓度下也是不稳定的,会衰变成普通的氧气。它的半衰期随大气条件如温度、湿度和空气流动而变化。在实验室条件下,半衰期(HLT)在室温(24℃)、零湿度、每小时换气次数为零的静止空气中平均为1500分钟(25小时)。
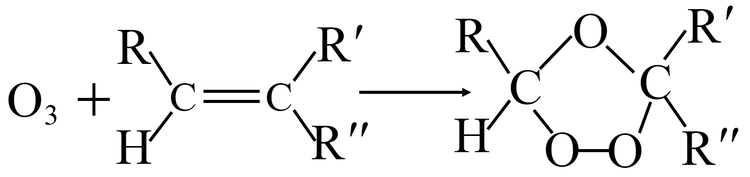
制备方法
紫外线照射法
该方法模拟的是大气层上空臭氧产生的原理,当使用紫外线(波长为185 nm)照射氧气时,部分氧气会分解为氧原子,这些氧原子与未分解的氧分子结合形成臭氧,该方法主要涉及如下反应:

危险公示标签(GHS) | H270 (100%): 可能引起或加剧火灾,氧化剂 [危险 氧化气体] H319 (100%): 引起严重的眼睛刺激 [警告 严重眼睛损伤/眼睛刺激] H330 (100%): 吸入致命 [危险 剧毒,吸入] |
上述资料来源于: |
环境影响
臭氧层
大气中的臭氧主要存在于大气层的最上层。地球上的生物之所以能安然无恙地生存,就是由于高空处有一个由太阳紫外线强辐射而形成的臭氧层。臭氧层存在于距离地面20—25公里处的大气层中,它能吸收 90%以上的对生物有害的太阳紫外线波段,而对生物无害的太阳紫外线却可全部通过。正是由于臭氧层这道天保护地面生物免遭紫外线辐射的伤害。研究表明,大气层里臭氧减小10%,有害紫外线的辐射量就将增加19~22%。
正常情况下,大气中的臭氧的合成速度和分解速度平时是处于平衡状态的,当大气受到了污染,臭氧的平衡状态就会受到破坏,导致臭氧的分解速度大于合成速度,局部大气层的臭氧浓度就会减小,减小到一定程度,就会形成空洞现象,这就是“臭氧层空洞”。人类在生产生活中排放的卤代烷烃(氟利昂为代表的)以及含氮化合物是破坏臭氧层的重要原因。
近地面
近地面臭氧是在光照条件下,由氮氧化物和挥发性有机物反应生成的二次污染物。近地面臭氧浓度过高,长期暴露会对人类健康造成影响,增加慢性阻塞性肺病的患病率和死亡率等。高浓度臭氧环境还影响植物的生命活动,进而对生态系统造成破坏。
健康危害
臭氧通过吸入或通过液体接触皮肤、眼睛或粘膜而具有高度毒性。它能够引起急性至慢性肺损伤、烧伤、死亡或永久性损伤。臭氧在100ppm的浓度下,1分钟就能产生毒性。臭氧能够导致肺水肿而死亡。它增加了肺部对支气管收缩剂和过敏原的敏感性,增加了对肺部细菌和病毒感染的易感性和严重性。在急性吸入接触的情况下,臭氧对肺部有致纤维化作用,并伴随着闭塞性支气管炎。
火灾危险
当受到冲击、暴露于热或火焰中,或与有机物,特别是还原剂发生化学反应时,有严重的爆炸危险。臭氧是一种强大的氧化剂。与烯类、芳香族化合物、苯、橡胶、溴、双氰胺、二乙醚、四氧化二氮、溴化氢、4-羟基-4-甲基-1,6-庚二烯、三氯化氮、苯乙烯、四氟肼不相容。不可燃,但会促进其他物质的燃烧。许多反应可能引起火灾或爆炸。与可燃物质接触时有火灾和爆炸的危险。
急救措施
类型 | 症状 | 措施 |
眼睛或皮肤与臭氧接触 | 刺激和灼伤皮肤、眼睛和粘膜 | 1.将受害者转移到空气新鲜处; 2.尽快脱去被污染的衣服 3.如果眼睛暴露,必须用温水冲洗眼睛至少15分钟 4.用肥皂和水彻底清洗暴露的皮肤部位 |
误吸入臭氧 | 呼吸出现异常、对肺部造成损坏、攻击神经系统导致头 晕、嗜睡等 | 1.将受害者转移到空气新鲜处,施救者应避免自我暴露在臭氧中 2.评估伤者生命体征,必要时进行心肺复苏 3.及时获得医疗机构的帮助 |
上述资料来源于: |
贮存与运输
由臭氧分子的结构特点和光谱吸收特性,在光照条件下,它会迅速分解成氧气。白天臭氧的寿命不超过3分钟,若环境为高温、潮湿条件,其分解则更快。但在黑暗、干燥和低温条件下,臭氧的寿命可长达15小时,这也是臭氧的储存或运输条件。使用冰水混合物储存臭氧是目前常用的方法,这是因为臭氧在冰水混合物中更加稳定,成本低廉。由于臭氧的极不稳定,一般来说,臭氧的生产往往遵循现用现制的原则。