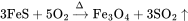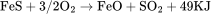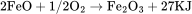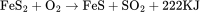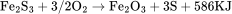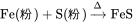环境分布 硫化亚铁形成于含硫酸根还原菌的还原环境中。硫酸根还原菌可以利用环境中的有机质作为碳源和代谢能量,将硫酸根(SO4 )还原为S后与离子态Fe或者铁氧化物反应形成FeS。其广泛存在于含有机质和硫酸根还原菌的还原环境中,如较深层土壤,地下水和江海河口沉积物等。黄铁矿是分布范围最广的硫化物,可以用来提取硫和制造硫酸,多存在于岩浆岩、沉积岩、变质岩的副矿物中,含有钻、镍、锌等物质。
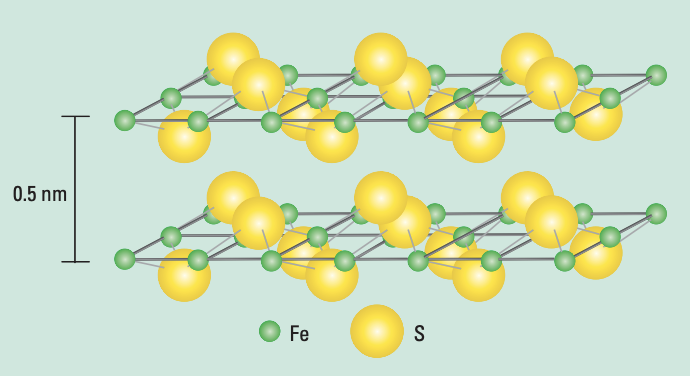
物质结构 硫化亚铁属于P4/nmm 空间群,有一个特殊的由四面体结合在一起的层状结构结构层沿c 轴方向延伸并通过范德华力结合在一起,如图1所示,
在硫化亚铁结构层中,每个Fe 原子与四个 S 原子通过配位作用形成共边四面体。四个Fe原子之间又分别以 0.26 nm 的距离连接成一个正四边形,这种短的距离可能导致Fe的d轨道电子在基面中广泛地离域,进而使FeS具有金属导电性。FeS具有的纳米级粒径和较大的比表面积使其表现出更强的吸附性能和反应活性,其表面活性位点决定它在水溶液的表面电荷。当FeS溶于水时,其晶体边缘的Fe原子和S原子可以通过水解作用形成羟基和巯基两种官能团。根据溶液的pH值,两种官能团都存在质子化和去质子化两种形态。当溶液pH低于FeS表面零点电荷pH值时,表面主要是≡Fe OH和≡FeSH官能团,而当溶液 pH 高于零点电荷 pH 值时则主要是≡FeOH和≡FeS,但是不同研究测出来的FeS表面零点电荷pH值相差较大。
理化性质 含杂质的硫化亚铁为灰色至棕色固体,纯品为无色六方晶体,比重为4.74,熔点1194℃,不溶于氧,难溶于水,密度为4.74g/cm。溶于无机酸,同时放出有毒和可燃性之硫化氢气体。其反应如下:
在空气中加热容易被氧化,其反应为
此外,硫化亚铁在潮湿空气中可以逐渐被氧化而分解成硫和四氧化三铁。
硫化亚铁及铁的其它硫化物在空气中受热或光照时,会发生如下反应:
制备
均相沉淀法:通过均相沉淀法,以硫代乙酰胺和硫酸亚铁铵为主要原料可以成功地合成FeS粉末。
辉光放电法:以硫的蒸气进行气体放电,在 160~180℃ 的温度和真空反应室中 (有阴极和阳极),当反应室中充满硫蒸气时,在阴极和阳极间施以高压直流电时,即产生辉光放电,硫离子与阴极盘上的工件产生物理化学作用与零件表面的元素化合,而成硫化物层。在 100~30℃温度下,能获得100~120m的FeS层。
离子渗硫法:离子渗硫 FeS层是在低温离子渗炉内190℃ 温度条件下渗硫处理3h所得。硫蒸气在直流高压电场作用下被加速冲向工件表面 ,使表面产生大量晶体缺陷,硫原子沿着晶界和缺陷向内扩渗,与Fe原子作用生成 FeS。
高温合成法:采用光谱纯的Fe和S为原料,将Fe车削成铁屑 ,采用氢气高温还原装置将铁屑进行还原处理 。
测定 不同样品中硫化亚铁的测定方法
各种炉渣中FeS的测定方法则基于在浸取金属铁后的残渣中,用溴—甲醇溶液选择溶解FeS,铁的氧化物留于残渣中;也可用溴—甲醇溶液同时浸取金属铁和FeS,测定二者铁的合量,然后减去金属铁量可得硫化亚铁的铁含量。
试样中硫化亚铁与非氧化性酸反应生成硫化氢气体,用乙酸镉和乙酸锌混合溶液吸收后产生硫化镉和硫化锌沉淀。加入过量碘标准溶液与硫化镉和硫化锌发生定量反应,剩余的碘以淀粉为指示剂,用硫代硫酸钠标准溶液滴定。根据实际消耗的碘量,即可求得硫化亚铁含量。
应用领域 硫化亚铁在实验室中用作分析试剂和制作硫化氢的原料。
硫化亚铁在工业上用于油漆、颜料和陶瓷的生产,还可用来制取其他亚铁盐。
硫化亚铁在造纸工业中用于制造亚硫酸盐溶液。
硫化亚铁可用作钢铁部件的固体润滑剂,具有FeS表面的零件主要有滚动轴承、多种轴活塞、多种齿轮等。使用寿命一般能延长1~10倍。无论干摩擦或油润滑、滚动或滑动以至切削,具有FeS表面润滑材料的零件,均具有良好润滑和减少摩擦磨损的效果,还能提高整机的机械效率。
作为电极:硫化亚铁电极具有理想的充放电性能,可应用于电极。集流体是硫化亚铁阴极的关键部件之一 ,当用泡沫镍等集流体 ,可用电镀方法在镍集流体上沉积一层铁 ,然后在熔盐体系中电化学合成硫化亚铁阴极 。泡沫镍的孔隙 、镀铁层的厚度 、硫化亚铁膜层的厚度和孔隙率大小等因素对电池性能有一定的影响。
去除环境污染物:硫化亚铁不仅可以去除铜,汞,铬,镉和铅等无机污染物,而且可以去除三氯乙烯,四氯乙烯等有机污染物。
安全事宜 健康危害 硫化亚铁有低毒性,大鼠经口以Fe计的LD50 为279~558mg/kg(bw)。人长期吸入该粉尘,可能引起尘肺改变;若不慎触及皮肤和眼睛会引起刺激症状;误服可引起胃肠刺激症状,并可能导致十二指肠假性黑变病。
急救措施 吸入
误吸入硫化亚铁后,应该保持呼吸道通畅,必要时辅助通气。当出现出血性胃肠炎引起的休克时应用静脉注射晶体液进行治疗,必要时更换血液,并且时刻监测休克情况。
眼睛
当眼睛接触到硫化亚铁时,应立即用水或生理盐水冲洗眼睛。
摄入
当摄入硫化亚铁时,如果患者可以吞咽、有强烈的呕吐反应并且不流口水,应进行漱口稀释。
中毒措施
患者发生轻度中毒时,会出现明显的低血容量,严重中毒时(例如休克、严重酸中毒和/或血清铁> 500-600 mcg/dL)应给予去铁胺进行治疗。应时刻监测患者尿液中去铁胺-铁复合物的情况。当尿液恢复正常或血清铁水平升高则可停止治疗。
环境 当加热分解时,它会散发出硫氧化物的有毒烟雾,其氧化是一种重要的地球化学过程,不仅导致酸性矿山废水的形成还会影响环境污染物的释放,迁移,降解和或化学形态的转化。
消防 硫化亚铁自燃的过程中如果没有一定的可燃物支持,将产生白色的SO2 气体,常被误认为水蒸汽,伴有刺激性气味,同时放出大量的热。当周围有其它可燃物(如油品)存在时,会冒出浓烟,并引发火灾和爆炸。
预防自燃的措施