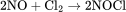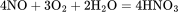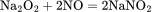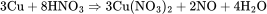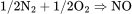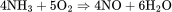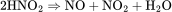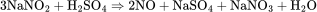研究历史 NO的发现和19世纪的研究 人类与氮氧化物(NOx)之间的关系有着悠久的历史,可以追溯到大约3000年前。NOx的第一次使用是作为食品防腐剂,可以追溯到中国和印度使用洞穴“壁硝石”[Ca(NO3 )2 ]腌制肉类。1901年,英国探险家斯坦因爵士在中国的佛教圣地敦煌发现了一批了不起的手稿。其中包括可能是世界上最古老的印刷书籍《金刚经》,它描述了公元800年左右的中国医疗实践。治疗心绞痛的一种方法是将硝基(KNO3 )放在舌下,用唾液浸泡,然后缓解和治愈。
简·巴普蒂斯塔·范·赫尔蒙(Jan Baptista van Helmont)(1580-1644)是最著名的炼金术士之一。范赫尔蒙被认为是第一位医学化学家,他也是“气动化学”的创始人,并以希腊语“khaos”的名字创造了“gas”一词。作为伽利略、哈维和培根的同代人,和伽利略一样,范赫尔蒙也因他的著作而受到谴责,他提到了一种红色气体,它是由富尔蒂斯水(硝酸)与银反应形成的,因此通常被认为是发现NO的人。当然,这种红色气体实际上不是NO本身,而是它与氧气反应的直接产物,二氧化氮(NO2)。尽管包括博伊尔(Boyle)、斯塔尔(Stahl)和黑尔斯(Hales)在内的几位著名化学家观察到硝酸与各种金属反应生成了NO,但直到约瑟夫·普里斯特利(Joseph Priestley)在1772年认识到NO是一种独特的化学实体。
一般来说,NO与金属的相互作用是一种主要的生物作用,约瑟夫·普里斯特利在1772年首次描述了NO与铁的反应,他用铁来产生一氧化二氮。NO和血红素之间的相互作用可以追溯到19世纪中叶,赫尔曼在1865年发现了脱氧血红蛋白的NO复合体。1897年,生理学家J.S.霍尔丹,证明了血红蛋白将亚硝酸盐还原为NO,后者与血红蛋白结合形成亚硝基复合体。在一个明显不同的领域,将NO与金属联系起来,1899年,基斯考特和雷曼都发现了赋予腌肉红色的盐的成分是来自硝酸盐的亚硝酸盐,两年后霍尔丹提出腌肉中的亚硝酸盐与金属之间的联系,提出实际上是亚硝酸盐产生的NO与肉类中的肌红蛋白结合,从而产生红色。早在1817-1822年,科纳就已确定腌制过程中硝酸盐的遗漏是“香肠中毒”的原因,1910年霍格兰解释了硝酸盐中亚硝酸盐的微生物和/或酶学来源。
在1867年T.L.布伦顿描述了第一个硝基血管扩张剂,亚硝酸戊酯,并建议它作为一种治疗心绞痛药物。1879年,穆雷尔发现NTG,并将其用作另一种硝基血管扩张剂
1900-1986中对NO的研究 在1986年至1988年的发现之前的20世纪,关于NO和人类健康的唯一科学知识基本上是作为空气污染和有毒气体的重要组成部分,从来没有人认为它实际上可以被内源生产和利用。在1916年的一项综合研究中,米切尔(Mitchel)等人证明了人类排出的硝酸盐多于摄入的硝酸盐,并得出结论:“人体组织能够从未氧化的含氮自由基中产生硝酸盐。”1925年,霍尔丹(Haldane)证明了败血症患者血液中存在NO-血红蛋白。1927年,瓦尔堡(Warburg)发现NO抑制线粒体呼吸,包括可逆和不可逆机制。
20世纪60年代和70年代,关于NO的化学研究激增,与生物学无关,主要是与过渡金属离子的相互作用。由于和氧气仅一个原子序数不同,NO已被广泛用作O2 代谢生物系统的光谱探针。特别重要的是电子顺磁共振(EPR)光谱学,始于1961年血红蛋白的NO复合物的EPR光谱的最初报道。亚硝酰血红蛋白复合物的EPR检测已被证明在揭示血红蛋白-O2 结合的变构机制的细节方面至关重要,因为光谱对与其功能结果相关的蛋白质构象(O2 与血红素铁的结合)非常敏感。
1986-88:在免疫、心血管和神经系统中发现内源性NO 在短短的3年时间内,在三个主要器官系统中发现内源性NO的突破显著集中。在这些看似独立的领域中的每一个领域,平行的进展都意外地发展到同时承认NO是调节器官功能的主要贡献物质。
免疫系统
1981年,坦南鲍姆使用稳定同位素分析,最终证明了硝酸盐的人类合成。坦嫩鲍姆(Tannenbaum)、赫格托恩(Hegesh)和夏伊洛(Shiloah) 在1982年独立地报告了与免疫系统的第一个联系,其中表明患有腹泻的个体排泄的硝酸盐比消耗的多得多。坦嫩鲍姆还表明,给大鼠注射脂多糖会导致硝酸盐排泄显著增加。在1985年,施图尔(Stuehr)和玛丽埃塔(Marletta)证明了至少在小鼠中,巨噬细胞是硝酸盐的体内来源,此外,用脂多糖(LPS)处理体外培养的巨噬细胞诱导了亚硝酸盐和硝酸盐的合成。随后的研究表明,LPS处理的巨噬细胞诱导不依赖于亚硝酸盐的亚硝化化学;这是首次表明哺乳动物细胞能够产生亚硝酸盐或硝酸盐的活性前体。
心血管系统
1971年厄尔·萨瑟兰因发现cAMP的信号特性而获得诺贝尔生理学或医学奖后,人们对其他环核苷酸作为信使的可能性产生了浓厚的兴趣。cGMP是唯一的另一种天然存在的环核苷酸,因此引起了特别的兴趣。1975年,穆拉德(Ferid Murad)和他的同事揭示了cGMP形成的关键机理,证明了叠氮化合物(后来证明其代谢为NO,以及在较小程度上的亚硝酸盐、苯肼和羟胺)有效地激活了可溶性鸟苷酸环化酶(sGC)。在1976年,芭芭拉·德鲁波提斯(DeRubertis)和克雷文(Craven)证明了亚硝胺、羟胺和亚硝酸盐的活化作用,并提出可能涉及这些化合物的“自由基形成”。1977年,穆拉德展示了亚硝酸盐和NTG的激活作用,1978年展示了血红蛋白和肌红蛋白的灭活作用。重要的是,穆拉德显示激活的化合物也能诱导平滑肌松弛。1977年,穆拉德首次将鸟苷酸环化酶暴露于NO,并提出由含氮氧化物的物质激活 "可能是由于一氧化氮或另一种反应性物质的形成,因为一氧化氮也增加了鸟苷酸环化酶的活性",1978年推测各种激素可能通过诱导NO从 "内源性前体 "形成而刺激sGC。
1979年,伊格纳罗(Ignarro)证明,与穆拉德研究的非血管组织一样,由氮氧化物化合物(硝普钠和亚硝胺)诱导的血管平滑肌松弛是由于NO激活鸟苷酸环化酶。卡托维兹(Kadowitz)和伊格纳罗还表明,硝基血管扩张剂是血小板聚集的有效抑制剂,这也是由NO诱导的鸟苷酸环化酶激活所介导的。
对sGC刺激机制的深入了解始于1978年,当时克雷文和芭芭拉·德鲁波提斯提出,含氮氧化物的化合物激活sGC的机制涉及亚硝基血红素,1981年盖尔泽(Gerzer)等人表明,纯化的sGC以1:1的比例含有血红素,NO与血红素铁结合。通过与之前对NO/血红素相互作用的研究进行比较,伊格纳罗和沃林(Wolin)提出了NO与血红素结合如何影响活化的机制解释,包括铁从血红素平面的位移,从而削弱/破坏近端组氨酸─铁键。这一结论在理论和实验上都得到了强有力的支持,并说明了NO作为铁配体的独特性质。
在1980年之前的27年里,弗奇戈特(Robert Furchgott)一直在利用体内和体外系统研究血管活性药物的作用机制。有一种药剂在弗奇戈特1980年的开创性发现中发挥了至关重要的作用,那就是毒蕈碱激动剂乙酰胆碱(Ach)。众所周知,乙酰胆碱在体内是一种有效的血管扩张诱导剂,但使用孤立的血管制剂,它只引起收缩。在一篇开创性的论文中,Furchgott证明,在体外研究血管段的制备过程中,内膜内皮细胞被常规且不知情地去除。当注意保护内皮细胞壁时,分离的制剂的反应类似于包括乙酰胆碱在内的几种血管活性药物的体内活性。也许最有见地的实验是演示了对一个完整节段的内皮细胞的刺激会引起第二个物理上相反的节段的放松,其中内皮细胞已被移除(“三明治”实验)。值得注意的结论是,内皮细胞产生一种物质[称为“内皮源性放松因子”(EDRF),该物质从内皮细胞自由迁移到平滑肌细胞以诱导放松。穆拉德很快证明了EDRF诱导的平滑肌松弛涉及cGMP[。1986年蒙卡达(Moncada)证明了EDRF与超氧化物反应,对EDRF的性质(以及对心血管病理生理学有很大影响的基础知识)提供了重要的见解。
神经系统
多年来,人们已经知道,大脑的许多区域,包括小脑、大脑皮层、纹状体和海马体,都含有大量的sGC和cGMP。小脑含有最高水平的cGMP,是其他区域的10倍,谷氨酸盐等兴奋性神经递质可诱导cGMP水平大幅升高。有趣的是,1977年出口(Deguchi)报道了神经细胞瘤细胞粗提物中存在sGC活性激活因子的突触体可溶性部分;随后的研究发现,激活剂为氨基酸精氨酸,其机制与亚硝基化合物引起的机制相似(包括血红蛋白的抑制)。1987年,加斯维特(Garthwaite)提出细胞与细胞之间的相互作用。
理化性质 物理性质
熔点:-163.6℃
沸点:-151.7°C
密度:1.04(相对气体密度)
蒸气压:34.2 atm
外观:无色气体,高浓度为棕色,固体为蓝白色
溶解性:微溶于水(7.38 ml/ 100 ml 0 °C; 4.6 ml/ 100 ml 20 °C; 2.37 ml/ 100 ml 60 °C),溶于乙醇(26.6 CC/100 CC)、二硫化碳、硫酸(26.6 CC/100 CC)
气味:尖锐、甜美的气味。
汽化热:3.293 Kcal/mole
电离势:9.27 eV
粘度:0.0188 cP(25℃、101.325 KPa)
折射率:1.0002697 (25 °C)
形成热:-21.5 Kcal/mole(18℃)
化学性质 NO在水中的溶解度较小,而且不与水发生反应。常温下NO很容易氧化为二氧化氮,也能与卤素反应生成卤化亚硝酰(NOx )。如
但NO与O2 可与水反应,化学方程式为
NO可以被过氧化钠吸收:
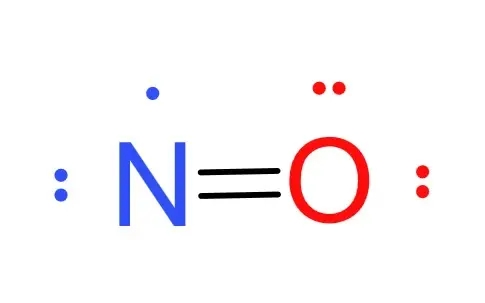
物质结构 一氧化氮为双原子分子,分子构型为直线形。一氧化氮中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键。氮氧之间键级为2.5,氮与氧各有一对孤对电子。有11个价电子,是奇电子分子,具有顺磁性。反键轨道上(πp*)1易失去生成亚硝酰阳离子NO。
制备方法 实验室采用铜和稀硝酸制备NO,这种方法安全简单,但铜的价格昂贵所以不适用于工业制备。方程式如下:
工业上用以下方法:
1、合成法:氮气与氧气在298 K和标准压力下,发生反应:
此方法在反应原理上虽然可行,但是氮气属于惰性气体且反应条件是放电,在现实生产中对设备要求高,局限性较大。
2、氨氧化法:在钯或铂的催化下,氨在氧气或空气中燃烧生成气体一氧化氮,反应温度控制在200~250℃。
不过这种方法是催化剂昂贵,而且NO容易和氧气反应形成NO2 。
3.热分解法:亚硝酸或亚硝酸盐加热到330℃以上,分解得到一氧化氮和二氧化氮。
这个方法会有二氧化氮副产物,而且亚硝酸和一氧化氮还有二氧化氮混合有爆照风险。
4.酸解法:采用亚硝酸钠与稀硫酸反应制取一氧化氮,反应方程式如下:
这种方法条件温和,操作简单,更加适合于工业生产。
应用领域 一氧化氮(NO)具有多种应用领域,以下是一些常见的应用:
医疗领域 一氧化氮可以用于医疗治疗。内源性NO,可以扩张血管,可以介导乙酰胆碱引起平滑肌舒张,从而调节血流和血压。对于吸入式NO可以缓解成人呼吸窘迫综合征,主要是因为NO可以降低肺内分流和肺动脉压力,从而不引起系统血管扩张。NO还可以治疗肺动脉高压。
工业领域 一氧化氮可以用于金属加工、燃烧和热处理过程中的氧化剂,用于生产硝酸、硝酸铵等化学品。此外,一氧化氮还可以用于生产合成氨、环氧乙烷、氰化物等化学品的中间体。
食品加工领域 一氧化氮可以作为食品防腐剂和食品色素使用,例如用于制造腊肠、火腿等肉制品,可使其保持红色、提高保质期。
生命科学领域
一氧化氮可以作为细胞信使分子在神经系统中发挥重要作用,参与调节血压、神经传递等生理过程。此外,一氧化氮还被广泛应用于生物技术、分子生物学等领域,例如用于细胞培养、蛋白质合成等。
总之,一氧化氮是一种十分重要的化学品,在许多领域中都有着广泛的应用和推广价值。
安全事宜 NO的毒理作用 一氧化氮迅速进入血液,迅速与血红蛋白反应,并被运送到全身。它能与氧合血红蛋白结合形成高铁血红蛋白和硝酸盐。高氧血红蛋白不与氧气结合,但如果血氧低,它可以与血红蛋白结合形成亚硝基血红蛋白。吸入一氧化氮毒性的一个主要原因是缺氧,这是由于甲氧血红蛋白形成而导致血液中氧气携带能力逐渐丧失。用于医疗的一氧化氮浓度取决于患者和疾病,但据报道,成人的一氧化氮浓度为20 - 80ppm,儿童为6 - 20ppm
健康危害 在短时间内接触少量后可能导致死亡或永久性伤害。刺激眼睛,鼻子,喉咙;可导致昏迷。一氧化氮在呼吸系统中形成酸,刺激并导致肺部充血。浓度为60-150 ppm会导致鼻子和喉咙立即刺激,喉咙和胸部咳嗽和灼热。暴露后6-24小时,可能导致呼吸困难和失去知觉。浓度为 100-150 ppm 对于 30-60 分钟的短时间暴露是危险的。200-700 ppm的浓度在非常短的暴露后可能是致命的。
火灾危害 仅用氢气加热时才燃烧。与二硫化碳发生爆炸性反应,与光的发射发生爆炸性反应。与一氧化氯混合时,可爆炸。遇三氯化氮爆炸。与臭氧混合时,会爆炸。会与水或蒸汽反应,产生热量和腐蚀性烟雾。与还原性材料发生剧烈反应。当加热分解时,会释放出剧毒的氮氧化物烟雾。可能点燃其他可燃材料(木材、纸张、油等)。与燃料的混合物可能会爆炸。容器可能会在火热中爆炸。室内、室外或下水道中的蒸汽爆炸和中毒危险。与氧气反应生成有毒的二氧化氮。避免存放在阳光直射或火灾危险高的地方。与铝、硼、二硫化碳、次氯酸盐、铬、氟、燃料、碳氢化合物、三氯化氮、臭氧、磷、uns-二甲基肼、铀、乙酸酐、氨、氧化钡、三氯化硼、氯甲烷、1,2-二氯乙烷、二氯乙烯、乙烯、铁、镁、锰、烯烃、钾、丙烯、钠、硫磺、三氯乙烯、1,1,1-三氯乙烷、UNS-四氯乙烷和还原剂。
包装和运输要求 包装标志:易燃气体。一氧化氮只能在通风良好的区域使用。不使用时盖好气瓶帽和阀出口塞。不可拖拉、滚动气瓶。不可采用以加热气瓶方法来提高排气速率。在排气管路上安装止回阀, 以防气体倒灌入气瓶。瓶应贮存在阴凉、干燥、通风良好的地方。CGA规定, 气瓶贮存区温度不允许超过51.7℃。空瓶和实瓶应分开竖放。
纯一氧化氮采用高压铝合金瓶装运, 不锈钢钢瓶阀。充装压力3.5MPa。运输、贮存及标记应符合《气瓶安全监察规程》的规定。