简介
镁具有很高的化学活泼性,在潮湿大气、海水、无机酸及其盐类、有机酸等介质中容易腐蚀,但在干燥的大气、碳酸盐、铬酸盐、氢氧化钠溶液、苯、汽油及不含水和酸的润滑油中很稳定。
镁占人体总重量的0.5%,是生命体中重要的功能元素,也是保证骨骼和牙齿健康所必需的成分;镁还是人体第二丰富的细胞阳离子,参与人体内多种化学反应过程,如与ATP,DNA和RNA等多磷酸进行反应。在植物体中,镁是叶绿素的核心元素,参与光合作用为地球上的生命体提供氧气和能量,维持生态平衡。
相关历史
1774年金属镁首次被人类发现,并以希腊古城Magnesia命名。
1755年,约瑟夫·布莱克(Joseph Black)在爱丁堡确认镁是一种元素,并辨别出了石灰中的苦土(氧化镁,MgO)。
1808年,戴维(H.Davy)在英国首次通过电解汞和氧化镁的混合物,制取镁汞齐,得到了金属镁。1828年,布赛(A.Bussy)在法国用钾还原熔融的氯化镁制得纯镁。1833年,法拉第(M.Faraday)在英国电解熔融氯化镁制得纯镁。1886年,德国首先采用电解法开始镁的工业生产。
第二次世界大战期间,意大利发明了在真空高温炉内用硅铁还原白云石来生产镁的工艺。加拿大皮金博士(Pidgeon)发明了在外热式真空蒸馏罐内用硅铁还原白云石制镁的新工艺。第二次世界大战后,1947年法国着手研究了连续生产的硅热法炼镁工艺,1969年建成年产4500 吨镁的半连续硅热法镁厂。
20世纪50年代以前,镁的发展依附于军事工业,60年代以后,镁在民用和空间技术的应用得到发展。近10年来,镁在交通、电子及通信等领域得到广泛应用,世界镁的消费量在迅速增长。
理化性质
物理性质
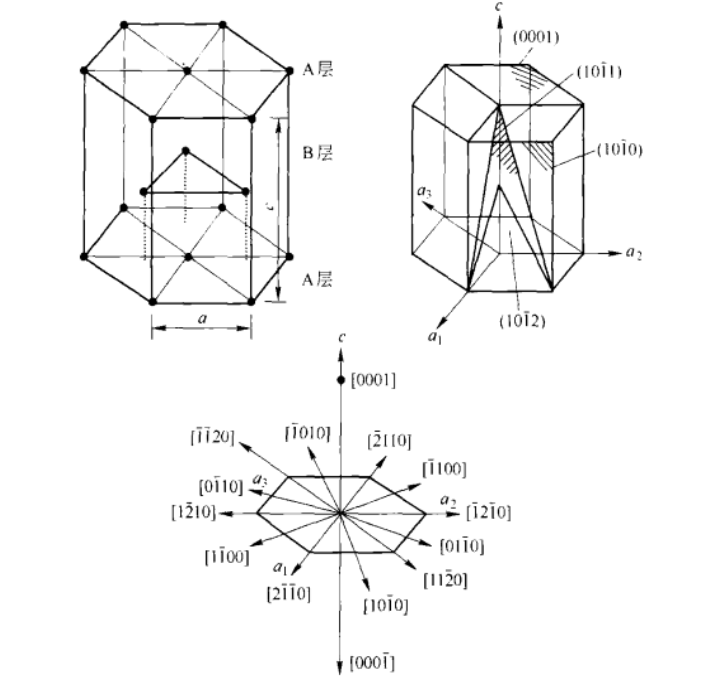
纯镁呈银白色,在室温下为稳定的固态,有着近乎完美的密排六方结构(hep)。标准大气压下,熔点为650 °C,沸点为1090 °C;随压力的增加,镁的熔点逐渐升高。镁的密度小,为1.74 g/cm;蒸气压215.95 Pa(627℃),1037.1 Pa(727℃);热导率1.57 W/(cm·K);电阻率4.47×10 π·cm。
金属镁的主要物理性质见下表:
镁的物理性质物理性质 | 物理参数 | 物理性质 | 物理参数 |
摩尔体积 | 13.99 cm/mol | 升华热 | 147.0(650 ℃)kJ/mol |
密度 | 1.74 g/cm | 比热容 | 1023 JkgK |
原子半径 | 1.73 Å | 电阻率 | 4.47×10 π·cm |
共价半径 | 1.40 Å | 导热率 | 1.57 W/(cm·K) |
熔点 | 650 °C | 标准电位 | -2.38 V |
沸点 | 1090 °C | 电化当量 | 0.453 g/(A·h) |
25 ℃时的熵 | 32.66±0.08 J/(mol·K) | 电离能 | 7.65 eV、15.34 eV |
同位素
Mg在自然界中存在3种稳定同位素,分别为Mg、Mg和Mg,其中Mg和Mg之间具有较大的质量差(8.33%),在各类地质过程中显示出不同程度的分馏,使之成为研究不同地质演化过程的有力指标和良好示踪剂。
2018年8月5日,S·萨卡尔等人发明了磁性镁同位素Mg在制造用于治疗缺氧的药物中的应用。提供具有低毒性和良好效率以在需要时以组织选择性方式治疗缺氧的药物。2012年10月,逯海等人将镁同位素分析技术应用于葡萄酒辨别,分析了不同地域的40种葡萄酒中镁同位素的组成。证明了镁同位素具有区分不同产地葡萄酒的能力,且地理分辨率较高的特点。
主要同位素元素符号 | 原子序数 | 质量数 | 中子数 | 同位素 | 原子质量 | 同位素丰度(%) | 原子质量 |
Mg | 12 | 24 | 12 | Mg | 23.985 | 78.99 | 24.305 |
25 | 13 | Mg | 24.986 | 10 |
26 | 14 | Mg | 25.983 | 11.01 |
化学性质
燃烧反应
金属镁与氧有很大的亲和力,在空气中非常容易氧化。金属镁在空气中引燃的温度为480-510 ℃,燃烧时能产生眩目的白光,因此镁作为镁粉燃烧有着不少应用,如作为闪光灯、烟花和海洋照明弹等。

2Mg + O2

图意 | 易燃物 |
GHS 危害声明 | H228(54.42%): 易燃固体 |
H250 (45.3%):暴露在空气中会自燃 |
H251 (19.74%): 自热;可能着火 |
H252(21.76%):大量自热;可能会着火 |
H260(45.58%):与水接触释放出可自燃的易燃气体 |
H261(54.31%):与水接触释放易燃气体 |
参考资料
消防相关
金属镁、金属铝都属于比较活泼的金属物质,很容易被氧化剂氧化,即易与氧化剂发生氧化还原反应。在镁铝合金的生产、加工、储存、运输过程中,镁铝混合粉不管是处于粉尘云状态(分散悬浮在空气或者其他气体中的粉尘称为粉尘云),只要遇到的热源具有足够高的温度,镁铝混合粉吸收能量值较大,就有可能被引燃,进一步可能诱发粉尘性爆炸。粉尘发生爆炸的必要条件之一是有效点火源,镁铝粉生产场所正确的选择防火防爆装置,能有效地避免粉尘着火。
健康相关
镁可引起严重的皮肤灼伤,镁烟雾可引起金属烟雾热;血清镁的正常范围为1.7-2.4 mg/dL。毒血症的治疗水平为5-7.4 mg/dL镇静,低血压发生在超过8-12 mg/dL的水平。心律失常和肌肉麻痹伴呼吸停止的水平超过12 mg/dL。服用含镁抗酸剂或宣泄剂的肾功能不全患者有风险。
急救措施
口服过量镁盐后,可催吐、洗胃,并大量饮水。
如有铸造热发生,可用物理方法及药物方法降温。
法规限制
2020年3月3日,中华人民共和国工业和信息化部为进一步加快镁产业转型升级,促进镁行业技术进步,提升资源综合利用率和节能环保水平,推动镁行业高质量发展,根据国家有关法律法规和产业政策,制定了《镁行业规范条件》。
2020年11月30日,《工贸企业粉尘防爆安全规定》审议通过,2021年9月1日起施行。其中第十五条规定:铝镁等金属粉尘湿式除尘系统应当安装与打磨抛光设备联锁的液位、流速监测报警装置,并保持作业场所和除尘器本体良好通风,防止氢气积聚,及时规范清理沉淀的粉尘泥浆。
2022年05月17日,国家铁路局公安部公布《铁路旅客禁止、限制携带和托运物品目录》,指出镁铝粉属于遇湿易燃物品,禁止携带。











