简介
铱元素具有43种同位素,即Ir-(163-205),铱元素有两种天然稳定存在的同位素¹⁹¹Ir和¹⁹³Ir,人工放射性同位素¹⁹²Ir可以用于治疗癌症。
铱金属、铱合金及其化合物由于化学性质稳定,被广泛应用于航空、电子、催化等领域,可作热电偶、电极、高温耐氧化涂层材料、电致发光材料等。铱金属可以通过冶炼矿石和提取铱废料得到的,铱薄膜可以通过磁控溅射法、化学气相沉积法等方法制备。
发现历史
铂系金属几乎都是以游离态存在于自然界中,分布广泛且分散,混杂在各种矿石之中,尤其是铂矿中。除了金和铂外,其余金属均在十八世纪以后才被发现。
当时研究铂的化学家将铂溶解在王水(盐酸和硝酸的混合物)中,他们总是能观察到少量不溶的黑色物质。法国化学家约瑟夫·路易斯·普鲁斯特(Joseph Louis Proust)认为该物质是石墨。1803年,法国化学家维多·科莱-德科提尔(Victor Collet-Descotils)、福雨克拉伯爵安东万·弗朗索瓦(Antoine François comte de Fourcroy)和路易·尼古拉·沃克朗(Louis Nicolas Vauquelin)也同样在铂的王水溶液中观察到黑色残留物,但因未获得足够的量没有进行进一步的实验。
同年,英国科学家史密森·台耐特(Smithson Tennant)对该不溶的黑色残留物进行分析,通过用碱和酸交替处理,将其分离成两种新的物质,这两种新元素分别为“铱”和“锇”。1804年,台耐特向伦敦皇家研究所报告发现了两种新元素。台耐特并根据“铱”所形成的各种化合物具有多种多样的颜色,将“铱”元素命名为“Iridium”,“Iridium”希腊语意为“虹”。
1813年,包括汉弗莱·戴维(Humphry·Davy)在内的一群化学家通过将铱暴露在强电流中证实铱能够像其他金属一样熔化。
分布情况
铂系金属(包括铂、铑、钌、钯、铱、锇六种金属)在地壳中的含量都极微,铱在地壳岩石中的平均质量分数甚至小于0.001 ppm。地壳中还存在一层非常薄的铱沉积物,因此地球上铱的总浓度被认为比地壳岩石中观察到的要高得多。
20世纪七十年代,科学家意外地发现白垩系-第三系界线粘土层中的铱元素含量异常,最高含量高达0.0091 ppm,异常时间与白垩纪-古近纪(K-Pg)生物大规模绝灭事件(当时70%的植物和动物均灭绝)相一致,有科学家猜测这二者之间有因果关系。美国物理学家路易斯·阿尔瓦雷斯(Luis W.Alvarez)提出了撞击绝灭理论,认为地壳中一层薄薄的铱沉积物主要是由太阳系小行星撞击引起的。
铱在自然界中以未结合的元素或天然合金形式存在,铱矿资源几乎都集中于铜镍型矿床中。铱矿资源主要分布在南非、俄罗斯、美国、加拿大等,如俄罗斯的干谷铂金矿床、加拿大的镍-锌型铂族元素矿床。中国铱资源主要分布在甘肃、四川、新疆、东北一带等,如攀西—滇中地区的杨柳坪铂矿。据美国地质调查局(USGS)2018年所公布的数据显示,铱金属在2018年的全球产量为7200 kg。
化学结构
电子结构
在铂系元素中,只有铱和锇元素的核外电子是能够正常排布的。铱的原子序数为77,核外电子数共有77个,其电子结构为1s²2s²2p⁶3s²3p⁶3d¹º4s²4p⁶4d¹º4f¹⁴5s²5p⁶5d⁷6s²([Xe]4f¹⁴5d⁷6s²)。由于铱价壳层的电子能量相差不大,因而具有多种价态不相同的氧化物。
晶体结构
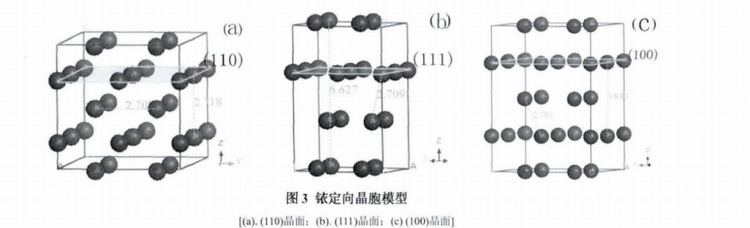
铱金属是立方面心结构,空间群为Cubic Fm-3m(空间群号:225),晶胞参数为a=b=c=3.8312,α=β=γ=90°。但是实际铱晶体并不是完美无缺的,常常有缺陷,少量的缺陷会影响晶体的性质,如机械强度、导电性等。
理化性质
物理性质
铱在常温常压下是一种银白色固体,熔点为2446 ℃,沸点为4428 ℃,常温下密度为22.56 g/cm³,熔化热为41.12 kJ/mol。铱在常温下的硬度较大,脆性也大,但是在高温下铱的脆性会转为韧性。
由于铱的耐腐蚀性能和抗氧化性能较强,且对可见光具有很高的反射率,因此其表面附有金属光泽。铱金属拥有较好的导电性能和导热性能,其电阻率为4.71 Ω·m,比热容为0.129 J/(kg·K)。铱金属具有良好的热电稳定性,和其合金可以组成热电偶,热电势随温度的变化而变化。铱金属具有热膨胀性,会随温度的升高而增大体积,随温度的降低而缩小体积。铱金属具有顺磁性。
同位素
铱有两种天然稳定存在的同位素¹⁹¹Ir和¹⁹³Ir,其天然丰度分别为37.3%和62.7%。铱有40多种同位素,质量数从163到205不等,其中还具有多种半衰期适中的放射性同位素。由于部分铱放射性同位素的自然本底极低,可作为核燃料燃耗指示剂。¹⁹²Ir介于两种稳定同位素之间,是铱最稳定的放射性同位素,半衰期为73.827天,它可以用于工业或医疗中“密封源”的生产。
表1:铱同位素的质量数和半衰期
铱同位素 | 质量数 | 半衰期 |
¹⁶³Ir | 163 | / |
¹⁶⁴Ir | 164 | 约1 ms |
¹⁶⁵Ir | 165 | 约50 ns |
¹⁶⁶Ir | 166 | 10.5 ms |
¹⁶⁷Ir | 167 | 29.3 ms |
¹⁶⁸Ir | 168 | 230 ms |
¹⁶⁹Ir | 169 | 353 ms |
¹⁷ºIr | 170 | 910 ms |
¹⁷¹Ir | 171 | 3.1 s |
¹⁷²Ir | 172 | 4.4 s |
¹⁷³Ir | 173 | 9.0 s |
¹⁷⁴Ir | 174 | 7.9 s |
¹⁷⁵Ir | 175 | 9.0 s |
¹⁷⁶Ir | 176 | 8.7 s |
¹⁷⁷Ir | 177 | 29.8 s |
¹⁷⁸Ir | 178 | 12 s |
¹⁷⁹Ir | 179 | 79 s |
¹⁸ºIr | 180 | 1.5 m |
¹⁸¹Ir | 181 | 4.9 m |
¹⁸²Ir | 182 | 15.0 m |
¹⁸³Ir | 183 | 58 m |
¹⁸⁴Ir | 184 | 3.09 h |
¹⁸⁵Ir | 185 | 14.4 h |
¹⁸⁶Ir | 186 | 16.64 h |
¹⁸⁷Ir | 187 | 10.5 h |
¹⁸⁸Ir | 188 | 41.5 h |
¹⁸⁹Ir | 189 | 13.2 d |
¹⁹ºIr | 190 | 11.78 d |
¹⁹¹Ir | 191 | 稳定 |
¹⁹²Ir | 192 | 73.8 d |
¹⁹³Ir | 193 | 稳定 |
¹⁹⁴Ir | 194 | 19.35 h |
¹⁹⁵Ir | 195 | 2.29 h |
¹⁹⁶Ir | 196 | 52.0 s |
¹⁹⁷Ir | 197 | 5.8 m |
¹⁹⁸Ir | 198 | 8.7 s |
¹⁹⁹Ir | 199 | 7 s |
²ººIr | 200 | 43 s |
²º¹Ir | 201 | 21 s |
²º²Ir | 202 | 11 s |
²º³Ir | 203 | 7 s |
²º⁴Ir | 204 | 2 s |
²º⁵Ir | 205 | 1 s |
化学性质
铱金属为惰性金属,化学性质不活泼,在室温下的空气中能够稳定存在,不易与酸、碱、活泼的非金属元素等发生反应,在高温下才能与氧化性强的卤素发生化合反应。铱的耐腐蚀性能较强,不溶于水以及常温下的硝酸、硫酸、盐酸、王水等溶剂,但如果体系中有强氧化剂(如高氯酸钠NaClO₃)的存在,加热至120 ℃左右铱可与盐酸反应。铱具有多种价态,主要表现为+3价、+4价。
铱金属的抗氧化能力较强,但粉末状的铱可以在加热至赤热条件下被氧化为黑色的二氧化铱(IrO₂)。铱还具有其他氧化物三氧化铱(IrO₃)、三氧化二铱(Ir₂O₃)。IrO₃几乎不以固态形式存在,在约1200 ℃时会以气态形式存在;Ir₂O₃不如IrO₂稳定,在高于400 ℃时会分解为O₂以及Ir、IrO₂的混合物,而且也不能得到很纯的Ir₂O₃,因为反应过程生成的Ir₂O₃水合物常常会吸附碱。


| 图意 | 易燃的 | 刺激性 |
H228(31.88%):易燃固体
H319(35.51%):导致严重眼部刺激
H413(63.04%):可能对水生生物造成长期有害影响
健康相关
块状的铂系金属通常为无毒的,但是可溶性卤化物盐具有高度的反应性,部分个体接触铱盐会引起免疫性、职业性接触性荨麻疹。部分的铱元素具有放射性(如¹⁹²Ir),直接接触可能会患上放射病,造成接触部位红肿溃疡,较长时间的接触还可能会造成染色体畸变。
消防措施
成块铱金属的危险性较小,细碎的催化金属可能在空中自燃,与卤素接触时发生剧烈反应或着火。
若由无放射性的铱引起的火灾,可以用水雾、干粉、泡沫或二氧化碳灭火剂灭火。
若由放射性的铱(如¹⁹²Ir)引起的火灾,请立即联系当地的管理辐射的部门。灭火人员必须穿戴防护用具,可以用干粉、泡沫或二氧化碳等灭火剂灭火,除此之外,还要在尽可能远的地方用大量水冷却所有受影响的容器。
急救措施
如果不小心吸入铱金属粉末,请立即将患者转移至新鲜空气处,若患者呼吸不顺畅需及时输氧,实时检测患者是否肺有水肿、休克、癫痫发作等现象;若眼睛中不小心进入了铱金属,请立即分开眼睑,用流动清水或生理盐水冲洗,冲洗结束后立即前往医院就医;若不小心误食铱金属,请立即漱口并禁止使用催吐剂,漱口结束后立即前往医院就医。











