适应证
用于预防新型冠状病毒(SARS-COV-2)感染所致的疾病(COVID-19)。
疫苗类型
灭活疫苗
附条件批准上市的3个新冠病毒灭活疫苗产品分别由国药集团中国生物北京生物制品研究所有限责任公司(北京所)、武汉生物制品研究所有限责任公司(武汉所)和北京科兴中维生物技术有限公司(科兴中维)生产。
重组亚单位疫苗
获批紧急使用的重组亚单位疫苗为安徽智飞龙科马生物制药有限公司(智飞龙科马)生产的重组新冠病毒疫苗(CHO细胞)。
重组病毒载体疫苗
腺病毒载体疫苗
附条件批准上市的腺病毒载体疫苗为康希诺生物股份公司(康希诺)生产的重组新冠病毒疫苗(5型腺病毒载体)。
减毒流感病毒载体疫苗
由厦门大学、香港大学、万泰生物联合研发的鼻喷流感病毒载体新冠肺炎疫苗获批紧急使用。
核酸疫苗
纳入紧急使用的核酸疫苗为石药集团生产的新型冠状病毒mRNA疫苗(SYS6006)。
中国已获批上市的新冠疫苗疫苗种类 | 名称 | 厂家 |
灭活疫苗 | 新型冠状病毒灭活疫苗 (Vero细胞) | 北京科兴中维生物 技术有限公司 |
新型冠状病毒灭活疫苗 (Vero细胞) | 武汉生物制品研究所 有限责任公司 |
新型冠状病毒灭活疫苗 (Vero细胞) | 国药集团中国生物北京生物制品研究所有限责任公司 |
新型冠状病毒灭活疫苗 (Vero细胞) | 深圳康泰生物制品 股份有限公司 |
新型冠状病毒灭活疫苗 (Vero细胞) | 中国医学科学院医学 生物学研究所 |
腺病毒载体疫苗 | 新型冠状病毒疫苗 (5型腺病毒载体)肌注式 | 康希诺生物与军事 科学院陈薇院士团队 |
新型冠状病毒 (5型腺病毒载体)吸入式 | 康希诺生物与军事 科学院陈薇院士团队 |
重组蛋白疫苗 | 重组型冠状病毒疫苗 (CHO细胞) | 安徽智飞龙科马生物 制药有限公司 |
新冠疫苗SCB-2019 | 三叶草生物制药有限公司 |
重组新冠疫苗(Sf9细胞) 威克欣 | 成都威斯克生物 有限责任公司 |
重组型冠状病毒疫苗 (CHO细胞)丽康V-01 | 丽珠医药集团股份 有限公司 |
重组新冠病毒二价(阿尔法/贝塔变异株)S三聚体蛋白疫苗 | 北京神舟细胞生物技术 集团有限公司 |
重组新冠病毒四价(阿尔法、贝塔、德尔塔和奥密克戎)S三聚体蛋白疫苗SCTV01E | 北京神舟细胞生物技术 集团有限公司 |
重组三价新冠病毒(XBB+BA.5+Delta变异株)三聚体蛋白疫苗(Sf9细胞) 威克欣3价XBB | 川大华西/威斯克生物 有限责任公司 |
减毒流感病毒载体疫苗 | 鼻喷流感病毒载体新冠肺炎疫苗 | 北京万泰生物药业股份有限公司 |
核酸疫苗 | 新型冠状病毒mRNA疫苗(SYS6006) | 石药集团 |
药理机制
预防性疫苗包含特定生物体的弱化或灭活部分(抗原),可在体内引发免疫反应。疫苗的作用就是使受种者的免疫系统产生相应的抗体,识别目标病原体,并形成免疫记忆,在未来目标病原体真正侵入身体时迅速做出响应。
灭活疫苗
使用非洲绿猴肾(Vero)细胞进行病毒培养扩增,经β丙内酯灭活病毒,保留抗原成分以诱导机体产生免疫应答,并加用氢氧化铝佐剂以提高免疫原性。
重组亚单位疫苗
将新冠病毒S蛋白受体结合区(RBD)基因重组到中国仓鼠卵巢(CHO)细胞基因内,在体外表达形成RBD二聚体,并加用氢氧化铝佐剂以提高免疫原性。
重组病毒载体疫苗
重组病毒载体疫苗是将腺病毒、减毒流感病毒等人类病毒作为载体,搭载目标病毒的蛋白质或编码目标病毒蛋白质的核酸进入受种者体内,甚至是细胞内,从而达成免疫的目标。
腺病毒载体疫苗
将新冠病毒的刺突糖蛋白(S蛋白)基因重组到复制缺陷型的人5型腺病毒基因内,基因重组腺病毒在体内表达新冠病毒S蛋白抗原,诱导机体产生免疫应答。
减毒流感病毒载体疫苗
由厦门大学、香港大学、万泰生物联合研发的鼻喷流感病毒载体新冠肺炎疫苗是采用经特别改造以提高安全性和有效性的双重减毒甲型流感病毒作为载体,插入新冠病毒刺突蛋白RBD基因片段研制而成。流感病毒具有与新冠病毒(尤其是奥密克戎变异株)高度重叠的从鼻腔开始的全呼吸道易感细胞解剖分布特点,因此该疫苗通过鼻腔喷雾方式接种可以模拟病毒自然感染方式在呼吸道形成预防新冠病毒入侵的第一线免疫屏障,且与肌肉注射式新冠疫苗诱导全身性保护的机制彼此互补,有利于形成更全面的保护。
核酸疫苗
由于病毒的蛋白质都是由宿主细胞来表达产生的,如果能够将编码病毒蛋白的核酸直接导入人体细胞,那么就可以由细胞生产出目标病毒蛋白质,并继而引发免疫反应。
风险与禁忌
不良反应
新冠病毒疫苗不良反应中的一般反应,主要表现为接种部位红肿、硬结、疼痛等局部反应,发热、乏力、头痛等全身反应,是一过性的、轻微的机体反应,通常不需要治疗。从新冠病毒疫苗临床试验研究结果、紧急使用期间和附条件上市后大规模人群使用收集到的信息看,中国新冠病毒疫苗常见不良反应的发生情况与已广泛应用的其他疫苗基本类似,绝大多数为一般反应。
新冠病毒疫苗不良反应中的异常反应,主要指造成受种者的器官或功能损害的相关反应,常表现为急性严重过敏性反应等,极少发生,需要及时就诊治疗。
禁忌
通常的疫苗接种禁忌包括:
对疫苗的活性成分、任何一种非活性成分、生产工艺中使用的物质过敏者,或以前接种同类疫苗时出现过敏者;
既往发生过疫苗严重过敏反应者(如急性过敏反应、血管神经性水肿、呼吸困难等);
患有未控制的癫痫和其他严重神经系统疾病者(如横贯性脊髓炎、格林巴利综合症、脱髓鞘疾病等);
正在发热者,或患急性疾病,或慢性疾病的急性发作期,或未控制的严重慢性病患者;
妊娠期妇女。
特殊人群用药
60岁及以上人群:60及以上人群为感染新冠病毒后的重症、死亡高风险人群。目前,4个附条件批准上市的新冠病毒疫苗Ⅲ期临床试验研究纳入该人群的数量有限,暂无疫苗对该人群的保护效力数据。但Ⅰ/Ⅱ期临床研究数据显示,该人群疫苗接种安全性良好,与18-59岁人群相比,接种后中和抗体滴度略低,但中和抗体阳转率相似,提示疫苗对60岁以上人群也会产生一定的保护作用,建议接种。
18岁以下人群:目前已有的疫苗尚未获得用于该人群的临床试验数据,暂不推荐18岁以下人群接种。
慢性病人群:慢性病人群为感染新冠病毒后的重症、死亡高风险人群。健康状况稳定,药物控制良好的慢性病人群不作为新冠病毒疫苗接种禁忌人群,建议接种。
育龄期和哺乳期女性:
①如果在接种后怀孕或在未知怀孕的情况下接种了疫苗,基于对上述疫苗安全性的理解,不推荐仅因接种新冠病毒疫苗而采取特别医学措施(如终止妊娠),建议做好孕期检查和随访。对于有备孕计划的女性,不必仅因接种新冠病毒疫苗而延迟怀孕计划。
②虽然目前尚无哺乳期女性接种新冠病毒疫苗对哺乳婴幼儿有影响的临床研究数据,但基于对疫苗安全性的理解,建议对新冠病毒感染高风险的哺乳期女性(如医务人员等)接种疫苗。考虑到母乳喂养对婴幼儿营养和健康的重要性,参考国际上通行做法,哺乳期女性接种新冠病毒疫苗后,建议继续母乳喂养。
免疫功能受损人群:免疫功能受损人群是感染新冠病毒后的重症、死亡高风险人群。目前尚无新冠病毒疫苗对该人群(例如恶性肿瘤、肾病综合征、艾滋病患者)、人类免疫缺陷病毒(HIV)感染者的安全性和有效性数据。该类人群疫苗接种后的免疫反应及保护效果可能会降低。对于灭活疫苗和重组亚单位疫苗,根据既往同类型疫苗的安全性特点,建议接种;对于腺病毒载体疫苗,虽然所用载体病毒为复制缺陷型,但既往无同类型疫苗使用的安全性数据。
既往新冠患者或感染者:现有研究数据表明,新冠病毒感染后6个月内罕见再次感染发病的情况。既往新冠肺炎病毒感染者(患者或无症状感染者),在充分告知基础上,可在6个月后接种1剂。
疫苗研发
研发背景
2019年12月底中国湖北省武汉市疾控中心监测发现不明原因肺炎病例。30日中国武汉市卫生健康委向辖区医疗机构发布《关于做好不明原因肺炎救治工作的紧急通知》。31日中国国家卫生健康委员会凌晨作出安排部署;派出工作组、专家组赶赴武汉市,指导做好疫情处置工作,开展现场调查。同日武汉市卫生健康委在官方网站发布《关于当前我市肺炎疫情的情况通报》,发现27例病例。提示公众尽量避免到封闭、空气不流通的公众场合和人多集中地方,外出可佩戴口罩。
2020年1月5日中国武汉市卫生健康委在官网发布关于不明原因的病毒性肺炎的情况通报,共发现59例不明原因的病毒性肺炎病例。根据实验室检测结果,排除流感、禽流感、腺病毒、传染性非典型性肺炎和中东呼吸综合征等呼吸道病原。同日中国向世界卫生组织通报疫情信息;世界卫生组织首次就中国武汉出现的不明原因肺炎病例进行通报。
新型冠状病毒肺炎(Coronavirus disease 2019, COVID-19)给人类健康和社会经济带来严重威胁。 截至 2022年 11月 22日,全球累计确诊病例超 6.28 亿人,累计病亡病例超659万人。疫情发生后,科研机构和制药公司迅速行动,积极开发 COVID-19 疫苗。
研发过程
中国
2020年1月7日,中国疾控中心已成功分离中国首株新型冠状病毒毒种,于1月12日向世界卫生组织提交了新冠病毒基因组序列信息,在全球范围内共享。这为各国病毒检测、治疗和疫苗研发奠定了基础。
疫情发生之初,中国国务院联防联控科研攻关组就将疫苗的研发作为主攻方向之一,设立了疫苗研发专班,布局了病毒的灭活疫苗、核酸疫苗、重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗五条技术路线。
截至2020年3月17日,5大技术方向疫苗总体进展顺利,第一批确定的9项任务都已完成临床前研究(即动物有效性、安全性研究)大部分工作,大部分研发团队4月份基本完成临床前研究,并逐步启动临床试验。其中,中国军事科学院军事医学研究院陈薇院士领衔的科研团队,成功研制出腺病毒载体重组新冠病毒疫苗,并于3月16日首个获批进入临床研究,已于2020年3月底完成了Ⅰ期临床试验受试者的接种工作,并于4月9日开始招募Ⅱ期临床试验志愿者,这是全球首个启动Ⅱ期临床研究的新冠疫苗品种。截至2020年5月,腺病毒载体重组新冠病毒疫苗Ⅱ期临床试验的508个志愿者已经注射完毕,处于观察期。
2020年4月12日,中国生物武汉生物制品研究所申报的新冠病毒灭活疫苗获临床试验许可,成为全球首家获得临床试验批件的新冠病毒灭活疫苗。其在中国北京、武汉、阿联酋阿布扎比三地启动新冠灭活疫苗临床Ⅲ期试验,标志着全球首个新冠病毒灭活疫苗国际临床Ⅲ期试验正式启动,同时也是中国原创的疫苗首次在国际上开展Ⅲ期临床研究。
2020年4月13日,北京科兴中维生物技术有限公司研制的新冠病毒灭活疫苗获批临床,于4月16日在江苏启动成人组(18-59岁)Ⅰ/Ⅱ期临床研究。截至2020年6月14日, Ⅰ/Ⅱ期临床研究受试者共743人已全部完成接种,揭盲结果显示,疫苗具有良好的安全性与免疫原性。
2020年4月27日,中国生物北京生物制品研究所研发的新冠病毒灭活疫苗获得国家药监局临床试验批件,于4月28日在河南正式启动临床试验。这也是中国生物技术集团公司获批临床的第二个新冠病毒灭活疫苗。
2020年5月7日,北京协和医学院秦川及中国疾病预防控制中心病毒病预防控制所武桂珍共同以通讯作者在《自然》(Nature)在线发表题为“The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice”的研究论文,该研究使用感染SARS-CoV-2的hACE2转基因小鼠研究病毒的致病性。该研究阐明了hACE2小鼠中SARS-CoV-2的致病性,并满足了Koch的假设,该小鼠模型可促进针对SARS-CoV-2的疗法和疫苗的开发。这也是首个全球新冠病毒疫苗动物实验结果。
2020年6月23日,阿联酋卫生部长向国药集团中国生物颁发临床试验批准文件,标志着全球首个新冠灭活疫苗国际临床试验(Ⅲ期)正式启动,志愿者入组接种6.3万人,覆盖125个国别人群。
至2020年上半年,中国已有1个腺病毒载体疫苗和4个灭活疫苗正式获得中国国家药监局批准开展临床试验,占全世界开展临床试验疫苗总数的四成,其他技术路线研制的疫苗也有望相继获批开展临床试验。
按照世界卫生组织截至2020年12月2日的统计,中国有15款疫苗进入临床试验,其中5款疫苗进入Ⅲ期临床试验。进入临床试验的疫苗已经涵盖了中国布局的所有技术路线。在全球,进入Ⅲ期临床试验的疫苗是中国最多,中国新型冠状病毒疫苗的研发处于全球第一方阵,比如国药中生的2款灭活疫苗,北京科兴的1款灭活疫苗,都是全球最早开展Ⅲ期临床试验的疫苗。由于中国的新型冠状病毒肺炎疫情控制很好,不具备开展Ⅲ期临床试验的条件,所以中国疫苗研发单位在完成Ⅰ期、Ⅱ期临床试验以后,都是采取国际合作的方式联合开展Ⅲ期临床试验。
2020年12月30日,中国国家药品监督管理局附条件批准国药集团中国生物北京生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。该疫苗是首家获批的中国新型冠状病毒灭活疫苗,适用于预防由新型冠状病毒感染引起的疾病(COVID-19)。2020年12月31日,中国国务院联防联控机制发布,该疫苗保护效力达到世界卫生组织及国家药监局相关标准要求。
2023年6月8日,川大华西/威斯克生物研发的重组三价新冠病毒(XBB+BA.5+Delta变异株)三聚体蛋白疫苗(Sf9细胞)-威克欣3价XBB疫苗被中国纳入紧急使用,这是全球首个获批紧急使用的针对XBB等变异株的新冠疫苗。
国际
全球范围内的新冠疫苗研发主要沿着灭活疫苗、基因工程重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体疫苗 、核酸疫苗等技术路线推进。截至2020年4月8日,全球共有115个候选的新冠疫苗处于不同开发阶段。
美国国家卫生研究院下属的国家过敏症和传染病研究所和莫德纳公司合作研发的mRNA疫苗已于2020年3月中旬开始临床试验;美国伊诺维奥制药公司研发的DNA疫苗也在2020年4月11日前开始临床试验,这种核酸疫苗使用了被称为“质粒”的环状DNA作为免疫原,注射后能使人体细胞产生病毒的蛋白,从而激发免疫反应。世卫组织的信息显示,截至2020年4月4日,另有约60款候选新冠疫苗处于临床前研究阶段,其中亚单位疫苗最为普遍,其次是核酸疫苗。包括中国复旦大学、香港大学以及澳大利亚昆士兰大学、英国帝国理工学院、印度药企卡迪拉公司等在内的全球多个团队。
研发进度
截至2022年11月底,全球获批或急使用授权(emergency-use-administration,EUA)的新冠疫苗共有33款;超过160个新冠疫苗项目在临床上推进,还有相当数量的新冠疫苗处于临床前研究。国际批准使用的新冠疫苗以腺病毒载体疫苗、重组蛋白疫苗、mRNA 疫苗为主。
研发现状
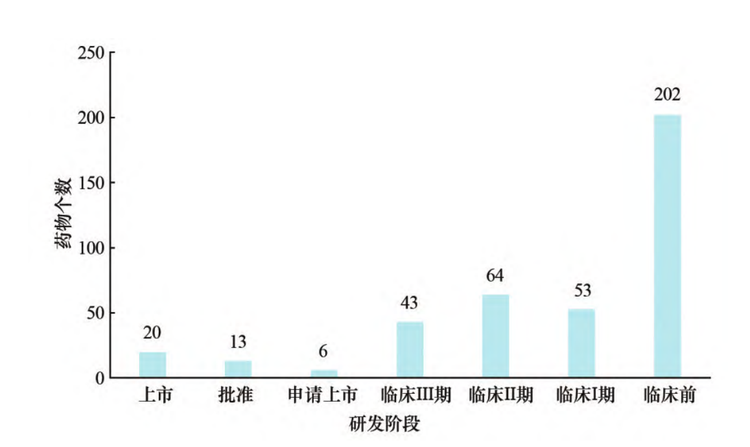
随着病毒的不断变异,开发针对新冠变异毒株的疫苗成为主要趋势。截至2022 年11月,全球管线中有6款处于上市申请阶段的疫苗,处于临床I、 II、III期的新冠疫苗分别有53、64、43款,另有超过200个处于临床前研究阶段。从技术上来看,mRNA创新疫苗得到快速发展。mRNA 疫苗是本次疫情中研究最为广泛的技术。在后疫情时代,mRNA平台技术迅速发展,更加有效的mRNA疫苗在持续开发中。据报道,全球大约有90家mRNA疫苗的领先机构,除已获批的7种mRNA新冠疫苗,另有3款处于上市申请阶段,尚有约90种mRNA候选疫苗处于研发管线中,其中,约40%已进入临床试验阶段。
中国
中国研发机构的mRNA疫苗开发起步较晚,但发展较为迅速,也有多个项目进入临床,如艾博生物联合军事科学院军事医学研究院、沃森生物共同研制的ARCoV是中国首个获批开展临床试验的mRNA疫苗 ,已进入临床III期阶段;斯微生物的新冠mRNA疫苗SW-0123也已在中国开展III期临床试验。另有康诺希生物等多家中国药企的mRNA疫苗处于临床研究阶段。
国际
国际上, Moderna公司利用mRNA和脂质纳米颗粒平台开展多个mRNA携带多变种多个基因突变的新冠增强疫苗候选项目 ,包括 :mRNA-1273.211、mRNA-1273.213、mRNA-1273.529、mRNA-1273.617等,均已经进入临床III期;辉瑞-BioNTech公司联合开发的mRNA新冠增强疫苗BNT-162b2s01、BNT-162b2 Omicron BA.1等也已进入临床III期。
虽然mRNA疫苗的技术壁垒较高,但未来发展空间较大。此外,也有研究认为,开发能够预防包括SARS-CoV-2在内的所有乙型冠状病毒甚至所有冠状病毒的通用疫苗是当务之急。
疫苗效力
灭活疫苗
2020年4月12日,国药集团中国生物制品研究所获得全球首个新冠病毒灭活疫苗临床批件并同步开展了Ⅰ、Ⅱ期临床试验,统计结果显示,疫苗接种后安全性良好;不同程序、不同剂量接种后,疫苗组接种者均产生高滴度抗体。同年12月9日,阿联酋卫生和预防部发布国药集团中国生物新冠疫苗Ⅲ期临床试验数据,并批准该疫苗成为全球首个正式注册上市的新冠疫苗。临床试验结果显示,疫苗保护效力86%,中和抗体转阳率100%,预防中度感染有效率100%,预防重症、危重症感染有效率100%。大规模接种后的真实世界研究结果显示,减少接种者住院有效率93%,减少对重症监护室需求有效率95%。
2020年10月15日,北京生物制品研究所有限责任公司等机构的研究人员在英国期刊《柳叶刀·传染病》上发表了中国一款新冠病毒灭活疫苗1期和2期随机对照临床试验,涉及超过600名年龄在18岁至80岁之间的健康志愿者,结果发现,所有志愿者在接种这一候选疫苗后42天内均产生了免疫应答,并且没有出现严重的不良反应,初步表明这种疫苗安全并且能够在健康的志愿者身上诱导产生免疫应答。
重组蛋白疫苗
智飞生物联合中科院微生物所开发的ZF2001重组蛋白疫苗,I期、II期临床试验结果于2021年3月在国际医学期刊《柳叶刀·传染病》发布。结果表明,疫苗安全性良好,接种3剂次25微克疫苗的97%入组者产生了可以阻断活病毒的中和抗体,中和抗体水平超过康复患者血清。同月在中国和乌兹别克斯坦,该疫苗获得批准紧急使用。
中国三叶草生物制药有限公司研发的三聚体蛋白疫苗SCB-2019Ⅱ/Ⅲ期临床试验显示,接种2剂SCB-2019对预防不同严重程度COVID-19的总体保护效率为67.2%,对预防中度至重度COVID-19的保护率为83.7%,对预防重度及需住院治疗的COVID-19患者保护率为100%,此外,该疫苗对德尔塔变异株引起COVID-19的保护效力为78.7%。
美国Novavax公司研发的NVX-CoV2373是一种含有Matrix-M佐剂的重组蛋白纳米颗粒疫苗。2021年上半年在美国和墨西哥进行的一项Ⅲ期临床试验将>18岁的成年人以2∶1的比例随机分配为接种2剂NVX-CoV2373疫苗组和安慰剂组,在3个月的时间里,有77例患者感染新冠病毒,其中接种疫苗组14例,接种安慰剂组63例,共发生了10例中度和4例重度病例,均为安慰剂接种者,该研究表明NVX-CoV2373疫苗对中度至重度疾病的疗效为100%。
重组病毒载体疫苗
腺病毒载体疫苗
强生公司的Ad26.COV2.S、阿斯利康公司的AZD-1222、来自俄罗斯的“人造卫星五号”(Sput⁃nik V)均为腺病毒载体疫苗,它们在临床试验中显示对预防危重COVID-19疗效比较显著。
中国军事科学院军事医学研究院生物工程研究所陈薇院士、江苏省疾控中心朱凤才教授等研究人员在中国对一种腺病毒载体重组新冠病毒疫苗开展了2期临床试验,2020年月20日该研究团队在英国医学期刊《柳叶刀》发表论文。据论文介绍,有超过500名志愿者参与,其中包括55岁以上人士,与1期临床试验相比参与者的范围更大。试验目的是评估这种疫苗能否诱导人体产生免疫应答以及是否有足够的安全性,结果显示疫苗在这两方面都产生了很好的结果,初步表明这种疫苗是安全的,并能诱导人体产生免疫应答。
牛津大学和阿斯利康共同研发的腺病毒载体疫苗AZD1222(ChAdOx1 nCoV-19)Ⅲ期临床试验研究了美国、智利和秘鲁成年人(包括老年人)接种2剂AZD1222疫苗或安慰剂后15d或更长时间内的安全性、有效性和免疫原性。结果显示,该疫苗严重不良事件和特殊关注的不良事件发生率较低,与安慰剂组相似;两组的局部和全身不良反应一般为轻度或中度,疫苗的总体有效性为74%,表明AZD1222在预防包括老年人在内的不同人群的症状和严重Covid-19方面是安全有效的。
减毒流感病毒载体疫苗
由厦门大学、香港大学、万泰生物联合研发的鼻喷流感病毒载体新冠肺炎疫苗在菲律宾、南非、越南和哥伦比亚等国入组了31038名18-91岁志愿者。临床试验数据显示,无论作为基础免疫还是序贯加强免疫,该疫苗对奥密克戎变异株感染导致的新冠病毒病(COVID-19)具有良好保护效果:
核酸疫苗
石药集团研发的新型冠状病毒mRNA疫苗(SYS6006))在疫情期间(2022年12月10日-2023年1月18日)开展的4000例序贯加强免疫临床研究(研究编号:SYS6006-008)中,以重组蛋白疫苗为对照,观察加强接种后7-28天,SYS6006的保护效力为70.2%(95% CI:53.6%-80.9%);观察加强接种后14-28天, SYS6006的保护效力为85.3%(95% CI:56.9%-95.0%)。
疫苗对于新冠病毒变异的情况
当新冠病毒发生变异后,疫苗的保护率及中和活性均会有不同程度的降低。研究表明,目前全球使用较为广泛的几款疫苗对预防Omicron毒株的有效性均明显下降。针对病毒不断变异的情况 ,2款获批效果显著的mRNA疫苗BNT162b2和mRNA-1273均成功更新原始株/Omi⁃ cron二价疫苗,二价疫苗对原始野生株和Omicron各变异株等都产生了强烈的中和抗体反应。
疫苗安全
全球大量的临床研究证据表明,新冠病毒疫苗对防发病、防重症、防死亡的效果非常显著,而且加强免疫可以进一步提高保护效果,中国疫苗对奥密克戎变异株引起的重症、死亡具有良好的保护作用。中国新冠病毒疫苗上市获得批准后有完整的监管流程来保证疫苗的质量,确保每一支疫苗来源可追、去向可查。根据中国国家疫苗监管监控体系的不良反应监测数据表明,中国新冠病毒疫苗是安全的。
中国疾控中心2021年5月28日发布中国新冠疫苗接种不良反应监测情况,2020年12月15日至2021年4月30日,31个省、自治区、直辖市以及新疆生产建设兵团报告接种新冠病毒疫苗2.65亿剂次,报告预防接种不良反应31434例,报告发生率为11.86/10万剂次。在不良反应中,一般反应26078例,占不良反应总数的82.96%,报告发生率为9.84/10万剂次;异常反应5356例,占不良反应总数的17.04%,报告发生率为2.02/10万剂次;在异常反应中,严重病例188例,报告发生率为0.07/10万剂次,发生概率在极其罕见(低于万分之一)的范围以内。中国新冠病毒疫苗的一般反应、异常反应发生率均低于2019年中国其他各类疫苗的平均报告水平。
接种计划
中国
坚持知情、同意、自愿原则,鼓励3岁以上适龄无接种禁忌人群应接尽接。倡导公众特别是老年人积极主动全程接种疫苗和加强免疫接种。
对于符合条件的18岁以上目标人群进行1剂次同源或序贯加强免疫接种,不可同时接受同源加强免疫和序贯加强免疫接种。
对于感染高风险人群、60岁以上老年人群、具有较严重基础疾病人群和免疫力低下人群,在完成第一剂次加强免疫接种满6个月后,可进行第二剂次加强免疫接种。提高60岁及以上老年人群等重症高风险人群的全程接种率和加强免疫接种率。
根据疫苗研发进展和临床试验结果,进一步完善疫苗接种策略。
美国
美国疾病控制与预防中心(Centers for Disease Control and Prevention, CDC)建议年龄在6个月及以上的人至少接种1次二价mRNA新冠肺炎疫苗。
没有中度或重度免疫缺陷的人群
初次接种时,根据疫苗产品:
未接种疫苗或以前只接种过单价疫苗的6岁及以上人群
中度或重度免疫功能低下的人群
在初次接种疫苗时:
既往接受过二价mRNA疫苗剂量的人群
诺瓦瓦克斯新冠肺炎疫苗
欧盟
未接种疫苗人群
随着SARS-CoV-2在欧盟/欧洲经济区国家的持续高传播,ECDC强烈鼓励尚未接种COVID-19初级疫苗接种系列或任何加强剂量的合格人群按照其国家的建议进行接种。为准备2022年秋冬季节,ECDC还强调了第二剂加强剂对重症风险最高的人群的重要性。
在一份关于COVID-6疫苗加强剂的使用和管理的ECDC-EMA联合声明中,考虑将加强剂作为重症风险较高的人的优先事项。危险因素包括:
年龄较大(例如 60 岁以上)
免疫系统问题
基础疾病
怀孕
应优先考虑长期护理机构的居民和工作人员以及医护人员。
已感染新冠病毒人群
感染后接种疫苗可加强保护并进一步降低再感染的风险。因此,通常建议符合条件的人群接种 COVID-19 疫苗,包括已从疾病中康复的人群。
儿童与青少年
与其他年龄组一样,患有使其处于严重新冠肺炎高风险的潜在疾病的儿童和青少年应被视为接种新冠肺炎疫苗的优先人群。这是为了确保他们免受严重疾病和住院的影响。
没有已知风险因素的儿童和青少年也容易患严重疾病和住院,尽管这些年龄组的新冠肺炎感染通常较轻,住院率仍远低于成人。
儿童和青少年接种疫苗还可以降低严重并发症的风险,如儿童多炎症综合征(MIS-C)。MIS-C是一种罕见的情况,可导致:
截至2022年10月20日,新冠肺炎疫苗Comirnaty和Spikevax已在欧盟/欧洲经济区获得授权,可用于6个月及以上的儿童。
德国
所有年龄≥18岁的人都应达到基线新型冠状病毒免疫水平。至少需与新型冠状病毒抗原接触3次(接种疫苗或感染)才能获得基本免疫。根据STIKO,3次抗原接触中至少有2次应通过疫苗接种实现,以建立最佳的基础免疫。
对于新冠肺炎免疫,应保持第一次和第二次疫给药之间至少间隔3周,第二次和第三次疫苗给药之间至少间隔6个月,以实现基本免疫。一般而言,如果与先前疫苗接种的间隔时间至少为3个月,则应仅将感染视为目标3次抗原接触的事件。另一方面,初次疫苗接种应在感染后至少3个月进行。
年龄>60 岁的人、年龄为6 个月或以上且患有与严重新冠肺炎病风险增加相关的基础疾病的人、在医疗保健和护理环境中具有增加的感染职业风险且与患者或常驻人员有直接接触的任何年龄的人,以及新冠肺炎疫苗接种不可能实现保护性免疫应答的个人的家庭成员和密切接触者,应在未来接受进一步的强化剂量治疗,通常是在最后一次已知抗原暴露后至少12个月。如果最后一次已知抗原暴露至少是在12个月前,则最好在秋季给予加强剂。
不建议< 60 岁的健康成人和孕妇使用其他增强剂。
对于无基础疾病的婴儿、(年轻)儿童和青少年,由于同时以轻度病程为主且住院率极低,因此目前不建议进行初级或强化新冠肺炎疫苗接种。
达到一定年龄且有迹象表明达到基线免疫或进一步加强剂量、有潜在疾病新发或有新的职业暴露的人应根据上述建议接种疫苗。
严重新冠肺炎病风险增加的潜在疾病可能包括:
免疫应答相关抑制的免疫功能低下人群(如器官或干细胞移植后、血液透析患者)可能需要至少相隔4周的额外疫苗剂量才能达到基线免疫。在接受疫苗剂量后至少4周,可通过定量测定针对新型冠状病毒尖峰蛋白的特异性抗体从血清学上监测对疫苗接种的免疫应答。如果尽管重复接种疫苗但仍未达到足够的免疫应答,则可增加剂量(例如增加一倍),因为可进行超说明书使用或施用基于不同技术的疫苗。对于免疫功能低下的个体,可能有必要缩短加强剂量之间的推荐最小12个月间隔时间,以维持保护性免疫应答。
使用情况
中国已上市的新冠疫苗共15款,覆盖了灭活疫苗、腺病毒载体疫苗、重组蛋白疫苗、减毒流感病毒载体疫苗、核酸疫苗5种类型。
2020年12月31日,中国国务院联防联控机制发布,中国国药集团中国生物的新冠病毒灭活疫苗已获中国国家药监局批准附条件上市,保护效力达到世界卫生组织及国家药监局相关标准要求,在中国各地陆续进行免费的接种。
2021年2月5日北京科兴中维生物技术有限公司的新冠病毒灭活疫苗“克尔来福”获批附条件上市,是中国第二个获批上市的新冠病毒疫苗。该疫苗已在2020年6月于中国获批紧急使用。2021年1月以来,印度尼西亚、土耳其、巴西、智利、哥伦比亚、乌拉圭等国陆续批准该疫苗在当地的紧急使用。同月25日,中国国家药品监督管理局附条件批准国药集团中国生物武汉生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。
2022年12月2日,经国家卫生健康委提出建议,国家药品监督管理局组织论证同意,由厦门大学、香港大学、万泰生物联合研发的鼻喷流感病毒载体新冠肺炎疫苗获批紧急使用。
2022年12月23日,中国31个省(自治区、直辖市)和新疆生产建设兵团累计报告接种新冠病毒疫苗346967.0万剂次。2023年5月10日,美国新冠疫苗接种已达676,728,782剂次,共有270,227,181人接种至少1剂,占美国人口的81.4%;已有56,478,510人接种了二价加强针。2023年7月8日,全球疫苗接种已达13,474,185,140剂次。
全球已批准使用的新冠疫苗药品名 | 公司 | 首批或EUA时间 | 上市国家/地区 |
Ad26.COV2.S | 强生 | 2020年7月 | 美国 |
Sputmik V(人造卫星五号) | 加马列亚流行病与微生物学研究所 | 2020年8月 | 俄罗斯、阿根廷 |
众爱可维 | 国药中生(北京) | 2020年12月 | 中国、阿联酋等 |
BNT162b2 | BioNTech、辉瑞、复星医药 | 2020年12月 | 美国、英国、加拿大 |
mRNA-1273 | Moderna | 2020年12月 | 美国、德国、加拿大 |
AZD-1222 | 阿斯利康 | 2020年12月 | 英国 |
Covaxin | 巴拉特生物 | 2021年1 月 | 巴西、印度等 |
众康可维 | 国药中生(武汉) | 2021年2月 | 中国等 |
CoviVac | 丘马科夫脊髓灰质炎及病毒性脑炎研究所 | 2021年2月 | 俄罗斯 |
克尔来福 | 科兴生物 | 2021年2月 | 中国、巴西等 |
Peptide vaccine | 俄罗斯国家病毒学和生物技术研究中心 | 2021年2月 | 俄罗斯 |
克威莎 | 康希诺 | 2021年2月 | 中国、巴基斯坦等 |
Jcovden | Janssen | 2021年2月 | 美国 |
智克威得 | 智飞生物 | 2021年3月 | 中国 |
可维克 | 康泰生物 | 2021年5月 | 中国 |
Sputnik Light | 加马列亚流行病与微生物学研究所 | 2021年5月 | 俄罗斯、委内瑞拉等 |
科维福 | 中国医学科学院医学生物学研究所 | 2021年6月 | 中国 |
COVlran Barekat | Shifa Pharmed | 2021年6月 | 伊朗 |
Zycov-D | Zydus-Cadila | 2021年8月 | 印度 |
Mvc-Cov1901 | 基亚生物科技 | 2021年8月 | 中国台湾 |
重组新冠病毒疫苗 | 国药集团中国生物研究院 | 2021年8月 | 阿联酋 |
CORBEVAX | Biological E | 2021 年12月 | 印度 |
NVX-CoV2373 | Novavax | 2021 年12月 | 欧洲 |
Sputnik M | 加马列亚流行病与微生物学研究所 | 2021 年12月 | 俄罗斯 |
MT-2766 | Medicago | 2022年2月 | 加拿大 |
VLA2001 | Valneva SE | 2022年3 月 | 巴林等 |
GBP510 | SK生物 | 2022年6月 | 韩国 |
GEMCOVAC-19 | Gennova Biopharmaceuticals | 2022年6月 | 印度 |
BNT162b2 原始株/0micron BA.4/BA.5二价 | BioNTech、辉瑞、复星医药 | 2022年8月 | 美国 |
mRNA-1273.214 | Moderna | 2022年8月 | 英国 |
mRNA-1273.222 | Moderna | 2022年8月 | 美国 |
BNT162b2 原始株/Omicron BA.1二价 | BioNTech、辉瑞、复星医药 | 2022年9月 | 美国 |
BBV154 | Bharat Biotech | 2022年9月 | 印度 |
公共卫生
“新冠肺炎疫苗实施计划”由全球疫苗免疫联盟(GAVI)、世界卫生组织(WHO)和流行病预防创新联盟(CEPI)共同发起并牵头实施,旨在加快新冠肺炎疫苗研发和生产,并确保各国公平获得疫苗,包括向无疫苗研发能力或低收入国家提供获得安全有效疫苗的渠道。
这项计划的初步目标是在2021年底前完成20亿剂疫苗生产,并将其中一半用于低收入国家。此计划能够分担疫苗开发风险,有效降低疫苗采购成本,保证疫苗公平分配。参与这项计划的国家和地区可即时有序获得该国家或地区至少20%人口所需疫苗,并能保证疫苗产品组合的多样化和积极管理。
2020年10月8日,中国与全球疫苗免疫联盟签署协议,加入“新冠肺炎疫苗实施计划”。中国的加入提升了全球力量和覆盖面,是对全球抗疫努力的有力支持。
截至2020年10月19日,已有184个国家和地区加入了这项计划。各国正在研发并登记在册的候选疫苗共有198种,其中44种已进入临床试验阶段。目前,“新冠肺炎疫苗实施计划”已纳入9种候选疫苗,其中2种来自中国。