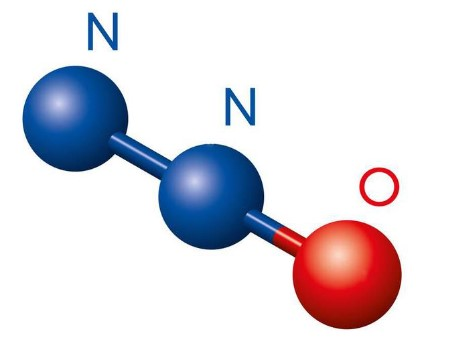
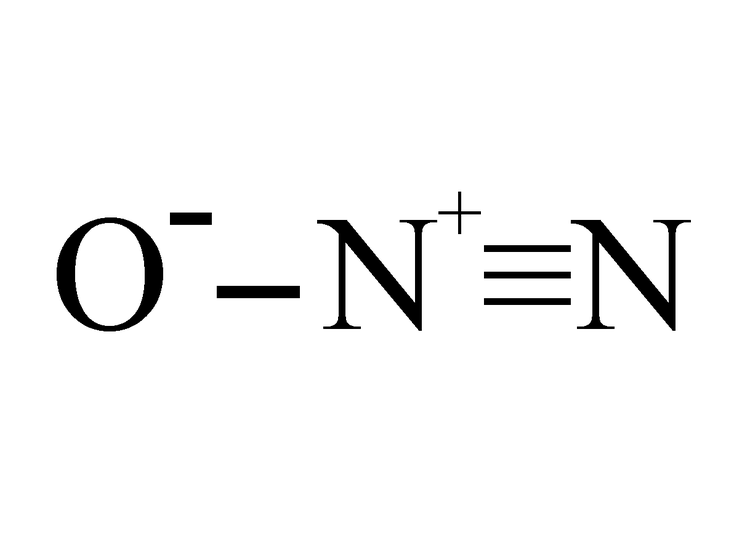发现历史
在1772年,英国化学家约瑟夫·普利斯特利(Joseph Priestley)在实验中首次发现N2O;1798年,贝多斯通过吸入该气体治疗肺结核和其他肺部疾病。1799年,另一位英国化学家汉弗莱·戴维( H.Davy)发现吸入 N2O 后能产生快感,并导致头晕,于是将该气体命名为“ 笑气”。
1800年,汉弗莱·戴维(Humphry Davy)出版了一本关于N2O的书籍,书中有这样一段话:“由于一氧化二氮能够消除身体上的疼痛,故可以在人体手术中得到应用”。
亨利·希尔·希克曼在1800年出生,硕士毕业于英国皇家医学院,在什罗普郡的德洛当医生时,他看到自己患者所遭受痛苦,就想减轻患者痛苦,就尝试用CO2、N2O等用于动物做手术时,发现能有效缓解动物的疼痛。他想将这个方法用于人体,但英国专业人士嘲笑这项工作,并谴责它是危险和无用的,他将该发现交给了巴黎的皇家医学院,未得到回复。之后,他失望的回到英国,在29岁时去世。
直到1844年,才清楚且明确的使用N2O作为全身麻醉剂,威尔士首选使用N2O 作为牙齿拔除时的麻醉剂 。1881年,在波兰首次作为分娩镇痛药;1993年,开发了一种混合氮气和氨气的双罐装备,使得N2O的使用更加方便。
药理特性
N2O
N2O对人体有镇痛、麻醉、抗焦虑等有利作用,但也有成瘾性,过多的吸食会导致缺氧,甚至心脏骤停等症状。
毒性机理
N2O具有成瘾性,吸食过后对人体的危害大。主要是它比氧气更易溶于水,一旦被吸入,它会比氧气更快穿过肺泡的基底膜扩散,然后迅速进入血液,导致肺泡中的氧气体积稀释。肺泡内氧张力的降低会导致氧气输送到大脑的减少,健康人在通风良好空间可以忍受这种类型的缺氧,但患有癫痫、心脏病或其他合并症的人,可能会起引起癫痫发作、心律失常甚至呼吸或心脏骤停。
药理作用
N2O的镇痛作用机理不是很明确,其中一种观点认为,它会增加人体自身的内啡肽、多巴胺,促进了大脑和脊髓中其他阿片类物质的释放,而阿片类物质通过
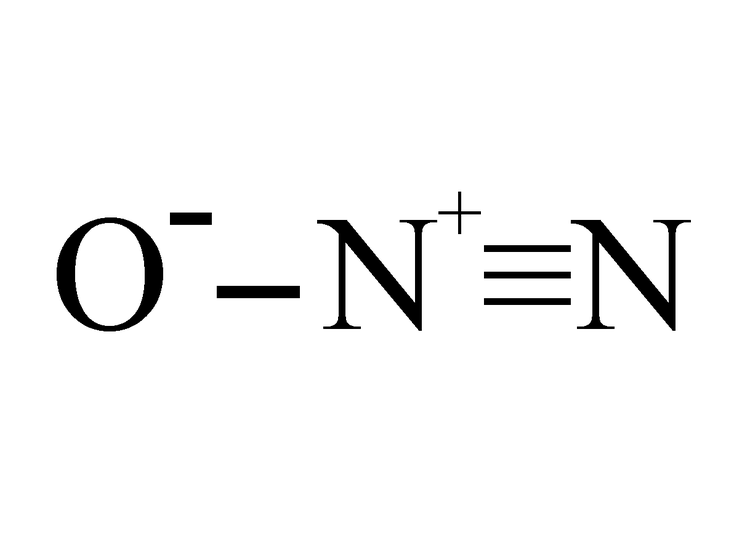
在一定压力下,N2O可以溶解于有机溶剂中,如丙酸、乙醇等溶剂中,也溶于一些无机盐溶液中,如氯化物、硫化物、亚硝酸盐溶液。
物理性质 | 关键参数 |
沸点 | -88.7℃(184.7K) | 临界温度 | 36.6℃(309.6K) |
熔点 | -90.7℃(182.3K) | 临界压力 | 7.25MPa |
密度 | 1.977Kg/m(T=0℃和P=0.1MPa) | 临界密度· | 0.452g/cm |
以上参考文献为: |
化学性质
在环境条件下,N2O是惰性化合物,在-50℃至50℃温度范围内,它是稳定的。N2O不与水、酸和碱的溶液反应,但在一定压力下,可以溶解与水中,在5℃时,水中溶解度为1.048;在20℃时,水中溶解度为0.629。它在水中溶解相对应的形式是不稳定的次硝酸H2N2O,它们容易分解成水和N2O。
2H2N2O = 2N2O + H2O
N2O不被KMnO4、Cl2O等强氧化剂氧化,在正常条件下不与O2反应,但在O2中加热超过500℃时,N2O被点燃并氧化。
2N2O + 3O2 = 4NO2 + 26.6KJ/mol
N2O也能与碱性金属和碱土金属以及一些过渡金属(Fe、Co 、Cr等)发生发应。
N2O + Fe = FeO + N2 +345.6 KJ/mol
N2O与氢气、氨气、氧化碳和碳氢化合物反应,能释放更多的热量。
N2O + 2NH3 = 4N2 + 3H2O +879.2KJ/mol
来源
2011年至2020年,平均全球N2O总排放量为17.2TgN/年,包括12.0TgN/年来自陆地、5.2TgK/年来自海洋。截止2021年,全球大气中N2O浓度达334.5±0.1ppb,大气中N2O溶度增加主要来源为自然来源(海洋、森林和热带稀树草原),其次是人为来源(发电厂、废水处理厂、内燃机和硝酸生产)。
自然来源
N2O的自然来源主要来自土壤中微生物分解,NO是复杂有机化合物在微生物分解过程中发生硝化和反硝化作用的结果。
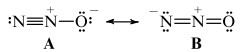
N2O分子的偶极矩较低,为0.161D,主要原因是A和B共振形式中电荷分布相反,它的N-N键长为1.128Å,比标准N=N键(1.24Å)短的多,相比于N≡N键(1.10Å)长的不显著。N-O键长为1.184Å,与标准N=O双键(1.21Å)非常相似,因此,N2O中的N-N和N-O键序分别为2.73和1.61。
检验方法
直接检测
使用传感器和分析仪直接检测N2O浓度。在传感器监测上,电化学、安培或电子传感器通常用于直接检测N2O浓度,但传感器检测范围存在上限,其灵敏度不适合在大气溶度下测量。便携式气体分析仪也可以直接检测N2O浓度,常用于现场连续测量。
采样检测
当无法直接检测N2O浓度时,采用被动和主动方法收集样本在实验室或移动设备中取样进行后续分析,以测量N2O浓度,采样的检测方法有:光谱法,色谱法。
安全事宜
环境
N2O是《京都议定书》中规定的6种温室气体之一,其全球变暖潜能值约为CO2的300倍,过去十年间,大气中N2O含量不断增加,而其又是一种典型的消耗臭氧层物质,造成臭氧层的破坏,引起直接辐射,导致全球气候的变暖。N2O的排放一半以上来自农业生产,主要是施加在土壤中的氮肥被微生物硝化、反硝化作用分解所致;工业生产中也会导致大量的N2O排放;燃料的燃烧以及废水处理都会产生N2O。
急救措施
吸入:将患者快速移到新鲜空气处,保持呼吸道通畅。如果呼吸困难,给输氧。如呼吸、心跳停止,立即进行心肺复苏,就医。
消防措施
N2O与强还原剂、易燃或可燃物等接触,会有发生火灾和爆炸的危险。在灭火时,切断气源;若不能切断气源,则不允许熄灭泄漏处的火焰。消费人员必须佩戴空气呼吸器、穿全身防火防毒服,在上风向灭火。尽可能将容器从火场移至空旷处。喷水保持火场容器冷却,直至灭火结束。

法律法规
中国
中国与国际上许多国家一样,未将N2O列入麻醉药品或者精神药品的管制目录,只是作为普通的化学品列入《危险化学品目录》(2015版),由安监等部门监管生产、运输、储存等环节安全。
在N2O的经营方面,中国国务院《危险化学品安全管理条例》第77条第三款有规定,在娱乐场所出现“笑气”是《危险化学品目录》中的N2O,且卖方没有经营许可证,可结合《中华人民共和国刑法》第二百二十五条非法经营罪、《中华人民共和国治安管理处罚法》第三十条进行判罚。
2019年11月12日,上海对一起大型非法经营“笑气”案进行了宣判。两名被告人违反国家规定,在未取得危险化学品经营许可证情况下,非法经营N2O,犯非法经营罪并追究其刑事责任。分别判处有期徒刑九年和五年六个月,并处罚金250万元和40万元,继续追缴二人违法所得。
欧洲
2021年6月起,法律禁止将N2O当做精神活性物质出售,违者罚款3750欧元。2023年3月27日,英国政府实施“反政府行为行动计划”,同时宣布禁止向公众出售N2O。