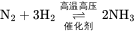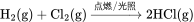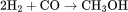发现历史 16世纪,瑞士医生帕拉赛斯·菲利普斯·奥利奥卢斯(Paracelsus Philippus Aureolus)发现当铁屑投入到硫酸会生成一种气体,这个气体就是氢气。17世纪,比利时科学家范·海尔蒙特(van Helmont)说过“干馏有机物会生成可燃气体”,该可燃气体就是甲烷、氢气、一氧化碳的混合物。17世纪中叶,英国化学家罗伯特·波义尔(Robert Boyle)将装满稀硫酸的长颈瓶倒置在同样盛有硫酸的液面上,将铁粒投入到大瓶里,一段时间后,长颈瓶中收集到一种气体,该气体即为氢气。这些科学家均未对氢气有进一步的研究。
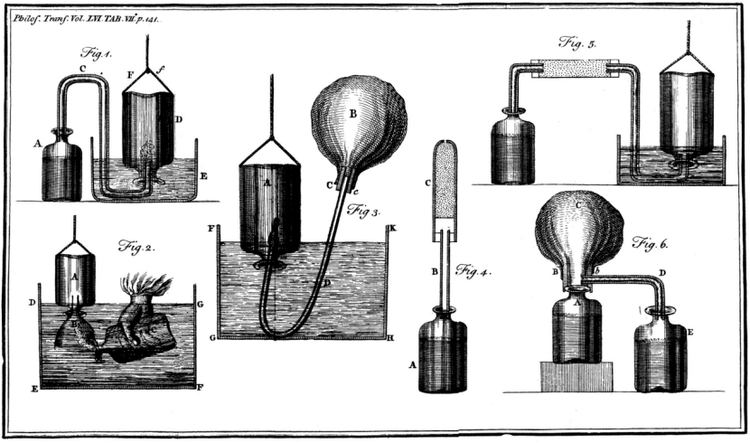
英国化学家亨利·卡文迪许(Henry Cavendish)是历史上公认的氢气发现者。1766年,卡文迪许发表的一篇研究报告《论人工空气》中描述利用一定量的铁、锌金属与足量的酸(如稀硫酸、稀盐酸)反应可制得“可燃空气”(即氢气)。他利用排水法将该气体收集起来进行了仔细研究,发现该气体与空气混合后遇火星会爆炸。然而,卡文迪许由于受到燃素说的影响,始终认为这种气体是一种燃素。直到1787年,法国化学家安托万-洛朗·拉瓦锡(Antoine-Laurent de Lavoisier)正式提出氢是一种元素并对其命名为“hydrogenium”。
1808年,英国物理学家约翰·道尔顿(John Dalton)在前人发现的基础上,创立了新的原子学说,主张用原子来解释各种化学现象,并且首次在化学领域引用原子量的概念,认为每种元素的原子重量是不变的。1811年,意大利化学家阿莫迪欧·阿伏伽德罗(Amedeo Avogadro)提出分子假说,分子是由原子构成的,双原子分子是由两个原子构成的,而稀有气体这类单原子分子则是由单子原子构成的。1858年,意大利化学家斯塔尼斯劳·康尼查罗(Stanislao Cannizzaro)对分子假说进行了验证。至此,确定了氢气是一种双原子分子组成的单质。
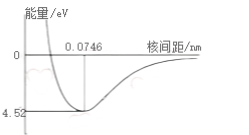
化学结构 H₂是H元素的单质形态,是最轻的双原子分子。每一个H原子在1s原子轨道上有一个电子,H₂分子的成键模型可以描述为两个H原子分别提供一个电子形成共价键。当两个H原子的核间距达到一定值时,体系能量达到最小值,此时平衡距离为0.0746 nm,键能为4.52 eV。
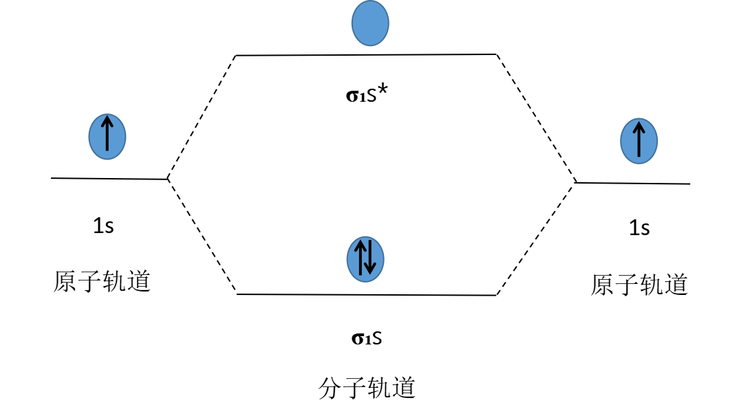
两个H原子的1s原子轨道可以线性组合成σ₁s(成键分子轨道)和σ₁s*(反成键分子轨道)。当电子进入成键分子轨道时,系统能量降低,电子进入反键分子轨道时,系统能量升高。两个H原子提供的两个1s电子会以自旋相反的方式进入能量较低的σ₁s成键分子轨道,形成1个以σ键结合的H₂分子,其分子轨道排布式为H₂[(σ₁s)²]。
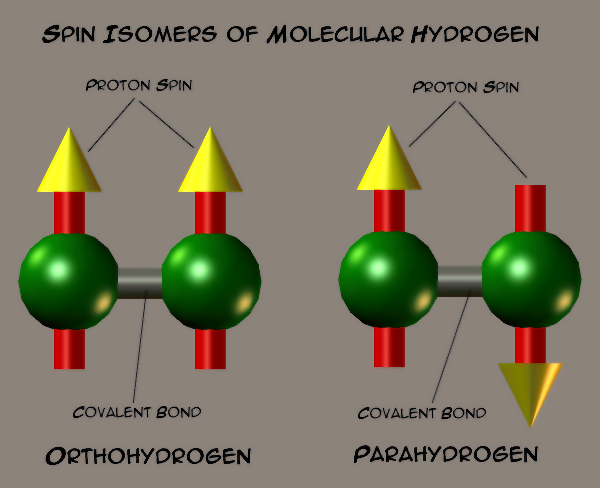
由于原子核的自旋不同,氢气会形成两种不同的自旋异构体。当两个原子核自旋方向相同时,为正氢;当两个原子核自旋方向相反时,为仲氢。氢气通常是正氢和仲氢的平衡混合物,室温下,氢气由75%正氢和25%仲氢构成。正氢和仲氢之间可以相互转换,当温度降低时,正氢会转换为仲氢,并释放出热量。
理化性质 物理性质 常温常压下,H₂是一种无色、无味、无毒的气体,具有体积小、分子量小、黏度低、抗磁性的特点。在100 kPa时,熔点为-259.2 ℃,沸点为-252.8 ℃,在25 ℃时的蒸气压为1.6×10⁵ kPa,在0 ℃,101.325 kPa的密度为0.08987 g/L,难溶解于水中,在21 ℃时水中溶解度仅为1.62 mg/L,爆炸极限为4.0%-75.6%。
同素异形体 由于氢元素具有多种同位素(如H、D、T),这使得氢气的原子组成也会大不相同,其中比较常见的有H₂、D₂、T₂、HD、HT、DT。
表2:氢气同素异形体的三相点与临界点
H₂
D₂
T₂
HD
HT
DT
三相点
温度/K
13.96
18.73
20.62
16.60
17.63
19.71
压力/kPa
7.3
17.1
21.6
12.8
171.7
19.4
临界点
温度/K
32.98
38.35
40.44
35.91
37.13
39.42
压力/kPa
1.31
1.67
1.85
1.48
1.57
1.77
正常沸点/K
20.39
23.67
25.04
22.13
22.92
24.38
氢有H、H₂、H₃和金属氢四种同素异形体。H₃是由三个H原子构成的不稳定分子,一般化学反应中不能形成,但是可以利用H₂轰击处在基态的H原子而得到。H₃极易失去电子形成H₃⁺离子,H₃⁺是最简单的稳定多原子分子,H₃⁺广泛存在于宇宙中,已在木星、天王星、土星等行星中探测到。金属氢是氢另一种不常见的同素异形体,在高压下,固体氢可以从绝缘相转变为金属导电相。金属氢拥有良好的导电性、导热性以及高密度、高超导转变温度,并且储存着巨大的能量。有学者认为木星、土星等行星中存在着金属氢。
化学性质 氢气的可燃性
氢气具有可燃性,能在空气或氧气中燃烧,发出淡蓝色的火焰,燃烧中释放热量。氢气的爆炸极限是4.0%-75.6%(体积浓度),即氢气在空气中的体积浓度在该极限之间时,遇火源就会爆炸,因此氢气在点燃前需要验纯。
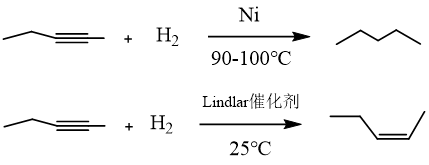
氢气可以与不饱和化合物(如含双键、三键、醛基化合物)发生加成反应,对于不饱和数目较多(n≥2)的化合物时,在不同的催化条件下可获得不同产物。
双氢配合物
双氢配合物是包含完整氢分子作为配体的配位化合物。自从1984年首次发现无解离的双氢配位以来,已报道了数百个双氢配合物,如[IrH₂(H₂)₂(PCy₃)₂]⁺、Cr(CO)₄(H₂)₂、RuH₂(H₂)₂(PCy₃)₂、W(CO)₃(PCy₃)₂(H₂)等。双氢配合物大多数都是过渡金属离子形成配合物。
制备方法 实验室制氢方法 ①活泼金属(如金属Ca、Na、Mg)与水或其他质子溶剂(如醇、液氨等)反应。
除直接电解水外,电解饱和食盐水(氯碱工业)也可得到副产品氢气。
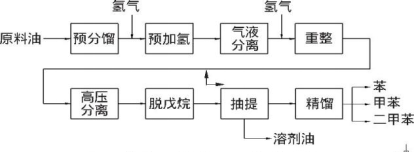
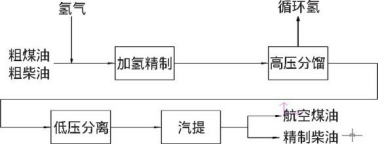
合成工业级化合物 氢气可以作为氨、盐酸、甲醇等多种工业产品的合成原料。氢气可以通过Haber-Bosch法在高温高压催化剂的条件下固定氮生成氨,氨是制作植物肥料、硝酸及硝酸盐重要原料之一。
由于氢气具有可燃性,与氯气可发生燃烧反应,生成氯化氢气体,溶于水制得盐酸。
氢气与一氧化碳可以制备粗甲醇,粗甲醇再经过精馏和化学处理提纯。
医疗领域 氢是一种尚未在医学广泛使用的物质,但经研究发现,它可以应用于多种疾病的治疗。氢拥有较强穿透性和极强的自由扩散能力,可以快速通过细胞膜并在体内扩散。再加上氢较强的还原性,使其具有选择性地抗氧化、抗炎、抗细胞凋亡等作用。氢可以通过吸入、含氢溶液静脉注射等多种手段应用于疾病的治疗。
氢气在癌症治疗中的作用
氢气不仅可以缓解常规化疗药物引起的副作用,也可以抑制癌细胞的生长。在化疗期间,体内会产生过量的活性氧(ROS),由于其高反应活性,会攻击细胞中的蛋白质、脂质等,导致细胞损伤或凋亡,氢气可以调节某些能消除ROS的抗氧化酶。前期氢气会使ROS水平下降,但由于补偿效应,后期ROS的增加反而会导致癌细胞的死亡。加上氢气的抗炎症特性,会缓解化疗后的不良反应。不仅如此,经研究,分子氢能够抑制胸腺淋巴瘤的生长速率,含氢盐水可以促进癌细胞凋亡,增加普通细胞存活率。
氢气对器官缺血再灌注损伤的保护作用
缺血再灌注(Ischemia-Reperfusion)损伤是组织或器官在缺血的基础上,由于血液和氧气重新供应所发生的不可逆性损伤。2007年,日本科学家Oshawa等人发现氢可以通过选择性地减少细胞毒性的羟基自由基(·OH),作为一种治疗性抗氧化剂保护神经元,改善脑缺血再灌注损伤。
经不断地研究可知,氢对心脏、肺、肝、肠和肾的缺血再灌注损伤均有器官保护功能,因为氢气具有抗氧化能力,可以减少体内的自由基或ROS,抑制氧化应激反应,从而保护组织免受损坏。
氢气在肾病治疗中的作用
顺铂是治疗癌症广泛使用的一种化合物,但顺铂的大量使用可能会造成肾毒性。然而吸入氢气或者饮用含氢水,可以对顺铂有保护作用,改善由顺铂引起的肾功能不全。富氢盐水对II型糖尿病也具有良好的治疗效果,不仅可以改善患者的胰岛素抵抗、促进脂类和葡萄糖的代谢,而且可以缓解糖尿病所引起的肾脏炎症反应。
安全事宜 危险性 氢气是极端易燃气体,与空气混合能形成爆炸性混合物,遇热或明火即发生爆炸。在铂及其它金属催化剂上,氢气和氧气在常温下即能发生爆炸反应。与氧化剂、卤素(氟、氯、溴、碘)、乙炔、氧化氮等化合物接触后,在一定条件下会剧烈反应,甚至爆炸。所以需要避免在静电、热、潮湿的环境下储存,不能与强氧化剂、卤素等物品接触。
消防相关 由氢气引发的火灾应用水雾、干粉、泡沫或二氧化碳灭火剂灭火。避免使用直流水灭火,直流水可能导致可燃性液体的飞溅,使火势扩散。当火灾发生时,应迅速切断气源。若不能立即切断气源,则不能熄灭泄漏处的火焰,应喷水冷却燃烧容器和临近容器,尽可能将容器从火场移至空旷处,防止容器受热爆炸。
急救措施 当吸入少量氢气时,应立即转移至新鲜空气处。皮肤和眼睛与液氢接触冻伤时,用大量水冲洗,冲洗后立即前往医院。当不小心误食时,立即漱口,禁止催吐,并前往医院就医。