相关历史
早在1702年,德意志化学家施塔尔(G.E.GeorgErnstStahl)用碱性溶液吸收硫磺燃烧生成的气体,得到亚硫酸盐溶液,所以后来将这种气体叫做无水亚硫酸(即二氧化硫)。1774年,英国化学家约瑟夫·普里斯特利(J.JosephPriestley)在用硫酸做加热实验时,无意间将水银倒入热酸中,发现有大量白烟生成并有臭味发出,后来他又用铜、铁、银、硫分别和硫酸共热,都生成了这种具有恶臭的气体。此时他才知道这种气体是由硫元素和氧元素组成。1807年,法国物理学家、化学家约瑟夫·路易·盖-吕萨克(JosephLouisGay-Lussac)通过对硫酸盐的加热分解并收集,发现生成的无水亚硫酸和氧气在容量上的比为2:1,由此可得无水亚硫酸中的硫与氧的重量比为1:1,因为当时还没有分子的概念。直到阿伏伽德罗分子学说确立后,才知道无水亚硫酸的分子式为SO2。
来源
自然与人为
二氧化硫的唯一天然来源是火山爆发,自然界产生的二氧化硫只占总量中很少的一部分。环境中大部分的二氧化硫来自人为排放,主要有以下三个来源:①含硫矿物燃料的燃烧;②含硫矿物开采和有色金属的冶炼;③还有一部分来自化学工业的生产过程,例如石油精炼、硫酸、亚硫酸盐、硫化橡胶、漂白纸浆等含硫化合物制造工业。
人体来源
人体内含硫氨基酸经代谢后可产生SO2,其中L-半胱氨酸在半胱氨酸氧化酶的作用下氧化L-为半胱氨酰亚磺酸,L-半胱氨酰亚磺酸通过两条途径代谢,其中一条途径在谷氨酸草酰乙酸转移酶的作用下转氨基生成β-亚磺酰丙酮酸,后者自发分解为丙酮酸和SO2。
体内代谢
环境吸入
大气环境中的二氧化硫主要经呼吸道进入机体,大部分在上呼吸道中被黏膜的湿润表面吸收(约40%~90%)。二氧化硫被吸收进入血液后立即与蛋白质结合(因此不能检测出游离的亚硫酸离子),并随血流分布到全身,在气管、肺门淋巴结和食道中含量较高。二氧化硫在亚硫酸氧化酶的作用下转化生成亚硫酸离子,再与蛋白质或小分子物质的硫化物键发生反应,形成R-S-SO3;最后经亚硫酸氧化酶催化与氧气结合生成SO4从尿中排出。亚硫酸氧化酶在肝脏最多,但在其他脏器也有分布。二氧化硫还能与起辅酶作用的维生素B1结合,破坏维生素B1与维生素C的结合,干扰体内维生素的平衡,从而影响机体的正常功能。
内源产生
人体内含硫氨基酸经代谢后可产生SO2,SO2在体内与水结合产生SO3,SO3再经亚硫酸氧化酶生成SO4,最后经肾随尿液排出体外;L-半胱氨酰亚磺酸还可以被半胱氨酰亚磺酸脱羧酶脱羧生成CO2和次牛磺酸,大部分次牛磺酸参与结合胆汁酸的代谢。
生理作用
内源性SO2在心血管系统调节中发挥着重要作用,它不仅具有舒张血管、抑制心脏功能、改善血管重构、抑制炎症反应、抗氧化以及调节脂质代谢等作用,而且对改善肺动脉高压、高血压和急性肺损伤等心肺血管疾病具有重要的病理生理学意义。研究表明,内源性SO2为心血管调节的新型气体信号分子。
有相关报道称内源性二氧化硫是机体重要的内源性防御体系,该体系异常是动脉粥样硬化、高脂血症、高血压、肺动脉高压、血管钙化、心肌肥厚及心肌缺血再灌注损伤等重大心血管疾病发生的重要机制。
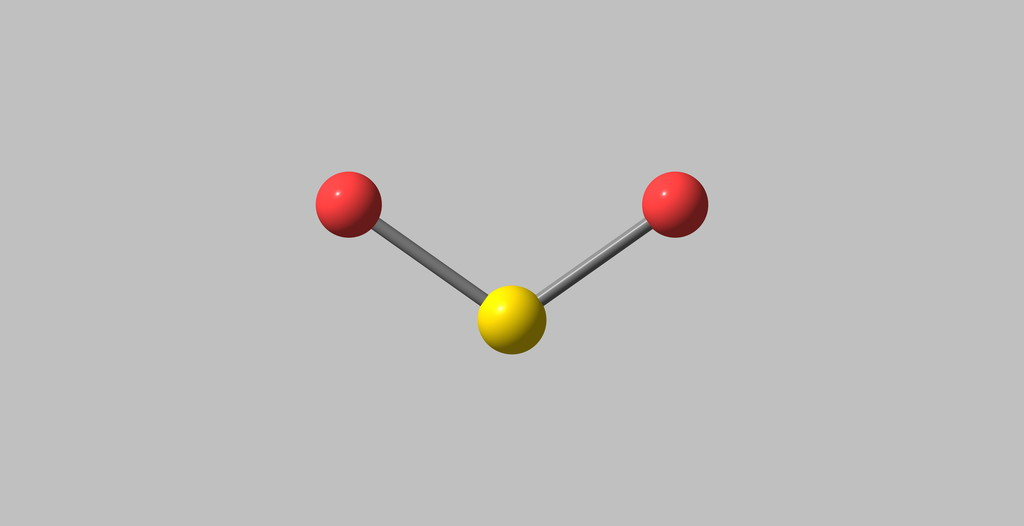
分子结构
二氧化硫的分子呈V形结构,其成键方式与臭氧类似,硫原子sp杂化,硫原子和两个配位氧原子除了以

理化性质
物理性质
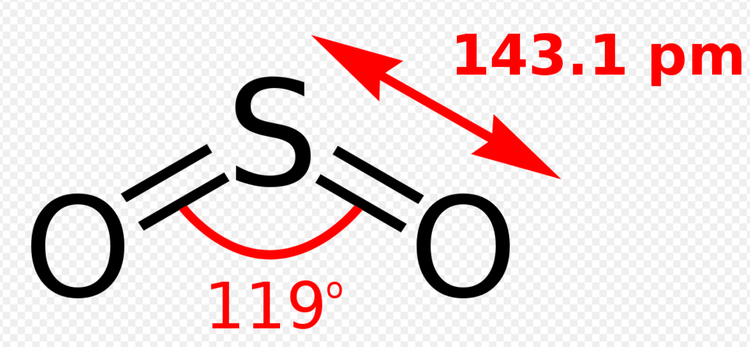
二氧化硫化学式为SO2,是一种具有强烈刺激性臭味的无色气体,可溶于水、乙醇,常温常压下,1体积水能溶解40体积二氧化硫,摩尔质量为64.07g/mol,密度为2.26g/cm,熔点为-75.5℃,沸点为-10℃。
二氧化硫气体易被液化,在330kPa(20℃)时液化,液体的密度为1.43g/cm。纯度为100%的二氧化硫气体在常温(30℃)下加压(绝对压力大于0.46MPa)可全部液化,在常压下用冷冻的方法(温度低于-10℃)也可以将二氧化硫全部转化为液体。工业生产液体二氧化硫,采用很高浓度(大于95%)或很低浓度(小于12%)的二氧化硫气体液化得到。
化学性质
与水反应
二氧化硫是酸性氧化物(亚硫酸的酸酐——亚硫酐),能与水反应生成亚硫酸。亚硫酸水溶液能被空气逐渐氧化为硫酸,浓度越低,氧化越快。亚硫酸水溶液一经加热就自行氧化。各反应式如下:

| 
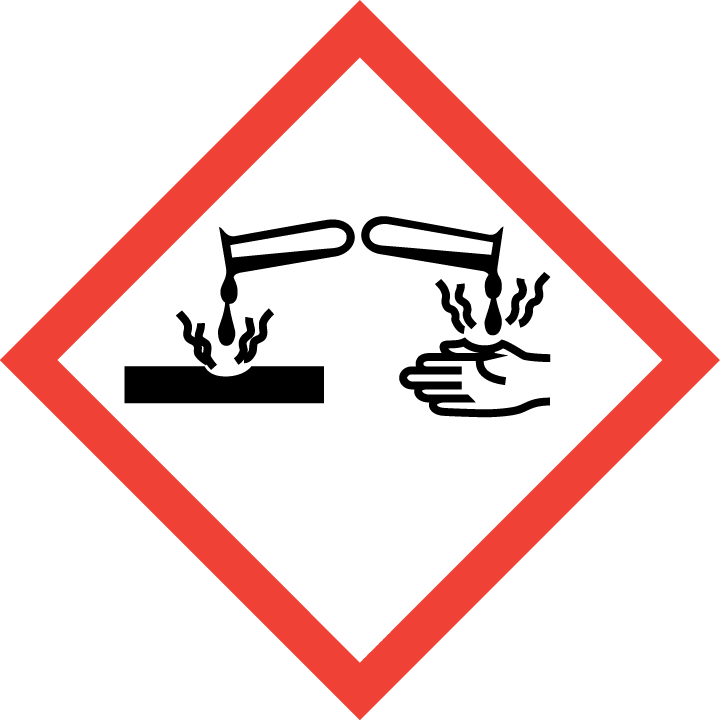
| GHS分类
GHS | 危险说明 | 危险等级 |
H314 | 造成严重的皮肤灼伤和眼睛损伤 | 皮肤腐蚀/刺激 |
H331 | 吸入有毒 | 急性毒性,吸入 |
毒性与接触
刺激性:家兔经眼:6x10/4h,32d,轻度刺激。
致突变性:DNA损伤:人淋巴细胞5700x10。DNA抑制:人淋巴细胞5700x10。
生殖毒性:大鼠吸入最低中毒浓度(TCL0):4mg/m,24h(交配前72d),引起月经周期改变或失调,对分娩有影响,对雌性生育指数有影响。
暴露途径:吸入,当空气中的二氧化硫浓度达20×10时可引起眼结膜炎、急性支气管炎,极高浓度时可导致声门水肿、肺水肿和呼吸道麻痹。
健康危害
二氧化硫易被湿润的黏膜表面吸收生成亚硫酸、硫酸。对眼及呼吸道黏膜有强烈的刺激作用。大量吸入可引起肺水肿、喉水肿、声带痉挛而致室息。①急性中毒:轻度中毒时,主要表现有眼及呼吸道黏膜的刺激症状,如眼睛灼伤、流泪、畏光、咳嗽,结膜及咽喉充血等;严重中毒可在数小时内发生肺水肿;极高浓度吸入可引起反射性声门痉挛而致室息。②慢性影响:长期低浓度接触,可有头痛、头昏、乏力等全身症状,以及慢性鼻炎、咽喉炎、支气管炎、嗅觉及味觉减退等。
泄露处理
迅速撤离泄漏污染区人员至上风处,并立即进行隔离,小泄漏时隔离150m,大泄漏时隔离450m,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防毒服。从上风处进入现场。尽可能切断泄漏源。用工业覆盖层或吸附/吸收剂盖住泄漏点附近的下水道等地方,防止气体进入。合理通风,加速扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生的大量废水。如有可能,用一捉捕器使气体通过次氯酸钠溶液。漏气容器要妥善处理,修复、检验后再用。
消防处理
二氧化硫不可燃。消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风向灭火。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷场地。
急救措施
皮肤接触:立即脱去被污染的衣着,用大量流动清水冲洗。
眼睛接触:提起眼脸,用流动清水或生理盐水冲洗。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
储存与运输
二氧化硫属于无机酸性腐蚀物品。贮存钢瓶应在低温、通风良好场所,避免日晒,远离高温物体。贮运时严禁泄露,搬运钢瓶时应轻拿轻放,切勿激烈振荡,避免引起爆炸。