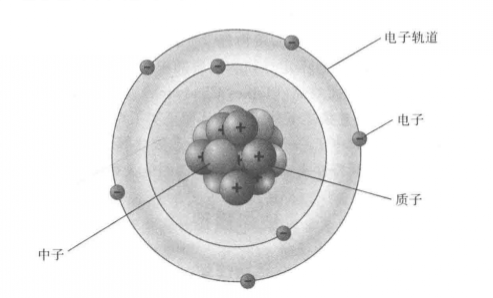
历史沿革
人类对原子结构的认识历史漫长的,也是无止境的。原子结构模型是科学家根据自己的认知对原子结构的描绘,一种模型代表了人类对原子结构认知的一个阶段。19世纪与20世纪交替时,同能量不是无限可分的这一性质(也称“能量的原子性”,即能量的量子化)的发现相反,元素的放射性和电子的发现(1897年J.J.汤姆逊通过实验确认了原子中电子的存在)导致原子的可分性逐渐被人们意识到。进入20世纪后,原子模型主要经历了道尔顿原子模型、汤姆逊原子模型(葡萄干面包原子模型)、卢瑟福有核原子模型(太阳系模型)以及玻尔原子模型等几个重要阶段。
古代的原子概念
公元前5世纪,古希腊哲学家留基波(Leucippus)和德克利特(Democritus)提出物质是由最微小、最坚硬、不可入、不可分的微粒组成的,并将这种微粒定义为“原子(atom)”。宇宙万物是由不同数目、不同形状的原子按不同的排列方式构成的。公元前4世纪,墨翟也提出了“端”的概念,即端是物质、不可再分的最小单位。1741年,俄国的罗蒙诺索夫(JOMOHOCOB)曾提出了物质构造的粒子说,但因实验证据不足,未被世人重视。
道尔顿原子学说
直到18世纪末19世纪初,英国化学家道尔顿(John Dalton)于1808年发表了有关原子学说的论文,提出了物质的最小组成单位为原子,原子不能创造、不能毁灭、不能分制;同种元素的原子其形状、质量、性质均相同,不同的元素则原子不同;原子以简单的比例结合成化合物。道尔顿的原子学说解释了一些化学现象。但道尔顿原子学说不能解释同位素的发现,没有说明原子和分子的区别,也未能阐释原子的具体组成和结构。
汤姆逊葡萄干面包原子模型

法国物理学家佩兰(Jean Baptiste Perrin)于1901年在一次演讲中提出一种原子结构模型,认为原子的中心是一些带正电的粒子,外面围绕着一些电子(带负电),电子运行的周期就对应于原子发射光谱谱线的频率。次年,开尔文(Kelvin)提出类似葡萄干面包的原子模型,认为原子是一个半径大约为10米的球体,正电荷就均匀地分布于整个球体,电子则稀疏地嵌在球体中。不久(1903年12月),J.J.汤姆孙(Joseph John Thomson)发展了这个模型,用来解释原子的各种性质。但也同在1903年12月,这个模型遭到了日本物理学家长冈半太郎(Hantaro Nagaoka,1865-1950)的批判。他认为正负电不可能相互渗透,而提出了一种他称之为“土星型模型”的结构。在长冈的模型中,电子均匀地分布在一个环上,环的中心则是一个具有大质量的带正电的球。他还根据麦克斯韦关于土星环运动稳定性的研究,得出了他的模型中这种环的运动方程。但他的计算,特别是稳定性问题的论断,立即受到了批判。因此,当时流行的还是葡萄干面包模型。这个模型以后终于被在英国曼彻斯特工作的德国物理学家盖革(H.Geiger,1882-1945)和新西兰物理学家马斯登(E.Marsden,1880-1970)的实验否定了。
卢瑟福有核模型
α粒子的散射实验
时间来到1909年,盖革和马斯登于观测
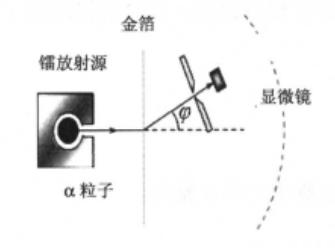
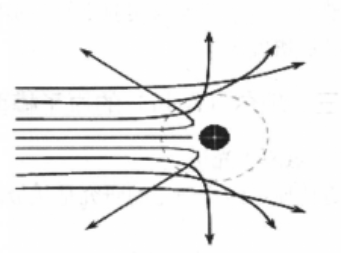
有核模型的建立与局限
卢瑟福的有核模型具体指原子中央是一个几乎占有全部原子质量的、带正电荷的核,电子在核的周围绕核转动,核的半径较原子的半径小得很多。因为原子核的质量比电子质量大得多,所以粒子的散射是由金属箔中原子的带正电荷的核所引起的,
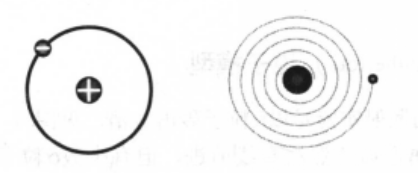
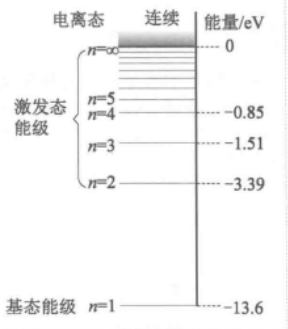
根据卢瑟福的有核原子模型,原子的中心有一个带正电的原子核,电子在它的周围高速旋转。电子的质量极小,因而原子的质量几乎全部集中在核上,原子核上的正电荷等于核外电子所带的负电荷数,所以整个原子是电中性的。绕核高速旋转的电子将不断地以电磁波的形式发射能量,电子在不断辐射能量的同时,自身能量减少。因此,电子运动的轨道半径将越来越小,离核越来越近,最终导致电子落到原子核上。有核原子模型所表示的是一个不稳定的体系。另外,由于电子自身能量的减少,电子绕核旋转的频率也会改变。根据经典电磁理论,辐射电磁波的频率将随着旋转频率的改变而逐渐改变。辐射频率的改变是随着能量连续变化而连续改变的。因此,原子发射光谱是连续光谱。然而,这一结论与实验不符。实验表明原子相当稳定,实验测得的原子光谱是不连续的谱线。
玻尔原子理论
玻尔于1911年以关于金属电子理论的研究论文取得博士学位后,即去英国剑桥大学卡文迪许实验室,准备跟J.J.汤姆孙(Joseph John Thomson)继续从事电子论的研究。但汤姆孙此时已对电子论不感兴趣,于是玻尔只好转到在曼彻斯特的汤姆孙以前的学生卢瑟福那里,当时卢瑟福刚提出有核原子模型,玻尔马上认识到它的重大意义,并且指出:这个模型可以把原子的化学性质和放射性质截然区别开来,即把前者归因于外围的电子,而把后者归因于原子核本身。1912年,正在英国曼彻斯特大学工作的玻尔将一份被后人称作《卢瑟福备忘录》的论文提纲提交给他的导师卢瑟福。在这份提纲中,玻尔在行星模型的基础上引入了普朗克的量子概念,认为原子中的电子处在一系列分立的稳态上。回到丹麦后玻尔急于将这些思想整理成论文,可是进展不大。1913年2月4日前后的某一天,玻尔的同事汉森拜访他,提到了1885年瑞士数学教师巴耳末(Johann Jakob Balmer)的工作以及巴耳末公式,玻尔顿时受到启发。这件事被称为玻尔的“二月转变”。1913年7月、9月、11月,经由卢瑟福推荐,《哲学杂志》接连刊载了玻尔的三篇论文,标志着玻尔模型正式提出。这三篇论文成为物理学史上的经典,被称为玻尔模型的“三部曲”,他在第一篇论文中着重阐述了有关辐射的发射和吸收,以及氢原子光谱的规律,在第二篇论文中论述了其它原子结构与周期表,在第三篇论文中探讨了分子结构。
理论基础
普朗克量子论——黑体辐射
19世纪末,随着X射线、放射性、电子三大发现,经典物理在解释黑体辐射、光电效应和原子的稳定性等现象时陷入了困境。1900年,普朗克(Max Planck)为了解决用经典理论解释黑体辐射规律所出现的“紫外灾难”,提出了能量子(量子)概念,打破了能只能连续变化的思维框架,宣告了量子物理的诞生。
黑体是一种完全能够吸收外来电磁辐射而不能对外反射和透射的理想物体。任何物体,只要高于绝对零度,就会以电磁波的形式向外辐射能量,而黑体辐射的特点是只取决于黑体的温度。黑体的温度不同,相应的单色辐射强度曲线各异,可得到很多辐射能量随波长分布的实验曲线。其中,当物体的温度为T时,单位时间从物体单位表面积上所辐射的在某长附近单位波长范围内的电磁波能量,称为该物体在温度T时的单色出度,以
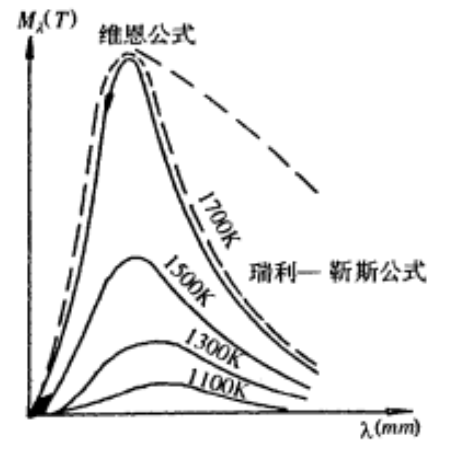
结合普朗克为了克服经典体系对解释黑体辐射现象的种种困难,提出物质辐射或吸收能量的假设:黑体的腔壁由无数带电谐振子组成,这些谐振子不断吸收和辐射电磁波与腔内辐射场交换能盘,这些谐振子具有的能最是分立的,于是振子与腔内辐射场交换能量时能量的改变值也只能是

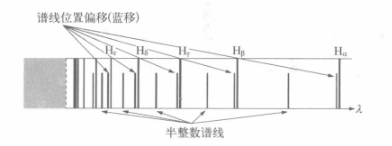
该式称为巴耳末公式,B为常数,其值为364.6纳米;n可以取不小于3的整数。用不同的n代入式中所得到的光谱线称为巴耳末系。波长为656.3纳米、486.1纳米、434.1纳米、410.2纳米的四条谱线分别对应于n为3,4,5,6。可以看出,巴耳末系中的谱线随的增大而越来越密,波长越来越短,当n趋于无穷大时,得到线系中最短波长
1889年,里德伯(J.R.Rydberg)提出了一个普遍的方程,将巴耳末公式可以等价地写为:
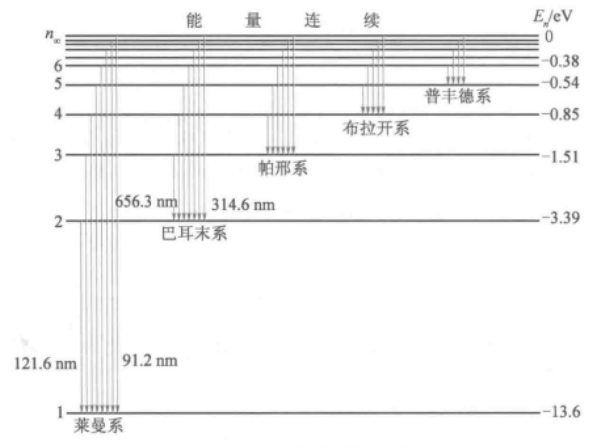
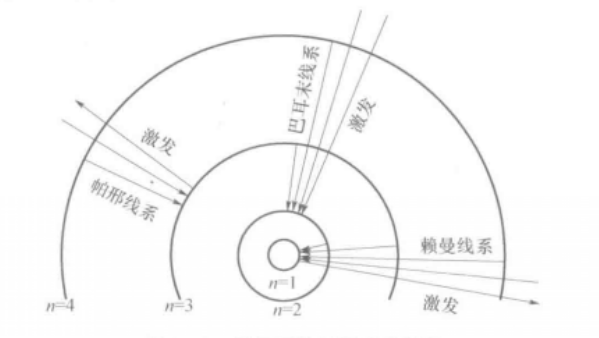
原子可以从较高能态向较低能态跃迁,并伴随光的发射。与n≥2的激发态向基态的跃迁相应的发射形成赖曼线系,由n≥3的激发态向n=2的跃迁相应的发射形成巴耳末线系。
轨道角动量量子化假设
玻尔发现,原子中电子绕核运动的轨道角动量L只能是
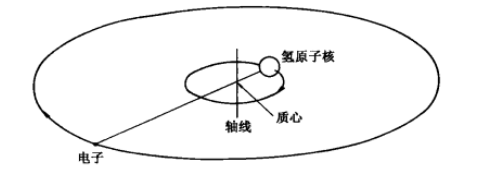
实验验证
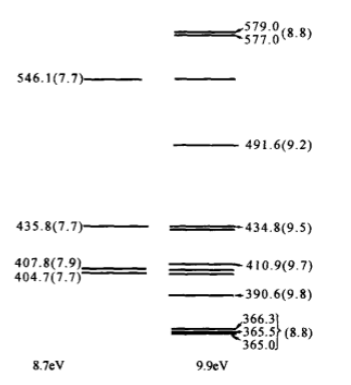
皮克林线系的验证—类氢光谱
1896年到1897年,美国天文学家皮克林(E.C.Pickering,1846~1919)在船舻座
莫塞莱定律验证
英国物理学家亨利·莫塞莱(Henry Gwyn Jeffreys Moseley,1887年11月23日—1915年8月)测定了多种元素的X射线标识谱线,发现它们具有确定的规律性,并得到了经验公式——莫塞莱定律。莫塞莱看到玻尔的论文,立刻发现这个经验公式可以由玻尔模型导出,为玻尔模型提供了有力的证据。
氘存在验证
1932年。尤雷(H.C.Urey)在实验中发现在的
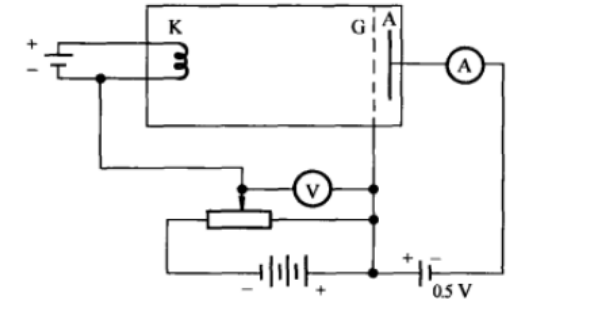
实验改进
1920年代,夫兰克和赫兹又继续改进实验装置,把加速与碰撞分在两个区域内进行,从而避免了原先装置中的缺点,可使电子在加速区获得更高的能量。实验结果证实了汞原子内部存在一系列量子态,证实了玻尔模型的正确性。
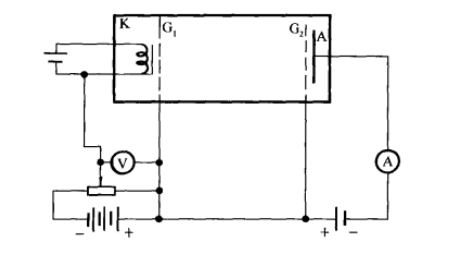
1924年,赫兹用上述改进后的装置重新做了实验,他在测量汞原子能级的同时还仔细观察汞的发射光谱。当电压加到8V时,汞的六个低激发态都能产生,因此,有可能发六条跃迁,但其中两条(185nm和253.7nm)处于紫外区,因此在可见光光谱仪中应能观察到四条谱线,实验结果确是如此。这些结果充分表明,原子被激发到不同的状态时它所吸收的能量是不连续的,即原子体系的内部能量是量子化的,夫兰克-赫兹实验有力地证实了原子中量子态的存在。

拓展与推广
1915年,德国物理学家索未菲(A.Sommerfeld,1868-1951)把玻尔理论从两方面加以扩充。首先,他仿照行星运动的规律,认为电子绕核运动不仅限于圆形轨道,而且包括椭圆形轨道。其次,他把狭义相对论效应同玻尔理论结合起来,考虑到电子的质量会随电子运动速率的变化而变化。经过这样的修正后所推算的结果,原来玻尔理论中的氢原子的一个定态,就分裂成若干能量稍有不同的定态。这样,原来一条谱线就分裂成若干条谱线,这就是光谱线的所谓“精细结构”,同实验观测完全一致。
以现在的认识看来,玻尔模型仍然是粗糙的,但它大大加速了量子力学的发展。1924年,受爱因斯坦光量子理论影响的法国物理学家维克多·德布罗意(Victorde Broglie)提出微观粒子具有波粒二象性的假设;1926年,奥地利物理学家埃尔温·薛定谔(Erwin Schroumldinger)在此基础上建立了波动力学。由此,科学家们利用量子力学的方法,很好地解释了原子核外电子的运动不遵循经典电磁学理论的现象,建立了现代的物质结构模型,即电子云模型原子内部围绕着原子核运行的电子形成一个高速运转的电子云团。
意义
玻尔的原子理论把当时人们持极大怀疑的卢瑟福模型普朗克-爱因斯坦的量子化与表面上毫不相干的光谱实验巧妙地结合了起来,很好地解决了卢瑟福原子结构理论中存在的稳定性问题,描绘出了一副完整而令人信服的原子结构图。其次,解释了近30年之谜巴耳末与里德伯的公式,首次算出了里德伯常量。理论中关于原子能量量子化,基态和激发态及量子跃迁等基本概念迄今仍然沿用。该理论的提出一方面对旧量子论做出了贡献,另一方面也率领了根本哈根学派完成了量子力学的根本哈根诠释,并影响了当时的众多物理学家,也使得玻尔获得了1922年的诺贝尔物理学奖。
局限
玻尔理论虽然取得了成功,但也存在其局限性。玻尔理论只能计算氢原子(或类氢离子)的光谱频率,而不能确定其谱线强度和精细结构。对于稍微复杂一些的原子,甚至简单性仅次于氢原子的氨原子玻尔理论都无能为力。可以说,玻尔理论首先它是在经典电磁理论和牛顿力学的基础上人为地加了一些假设条件,因而未能彻底突破经典物理学的框架;其次,这种假设是为了解释氢原子的线状光谱结构而提出的,没有理论依据,也不能赖以预言其他原子应具有怎样的能级结构。对原子世界,或者更一般地说,微观世界更完整、更准确的描写就是以后建立的量子力学。尽管如此,玻尔理论在原子物理和量子力学发展过程中所建立的功绩仍然是不可磨灭的。
应用
玻尔原子理论作为物理学基础理论研究的重大进步,帮助人类认识到原子结构内部如何运行,奠基了众多领域的发展,例如19世纪的核工业、激光技术等,也进一步解释了光谱现象以及元素周期表的性质等。
解释光谱现象
玻尔理论能很好地解释了氢原子光谱。光谱不连续性正来自原子中电子能量的不连续性。氨原子在正常状态总是处于能量最低的基态,当原子受到光照射或放电等作用时,吸收能量,原子中的电子跳到能量较高的激发态。原子处于这种激发态总是不稳定的,总是倾向于回到能级较低的轨道。当电子由能量较高的各轨道跳回到能量较低的各轨道时,放出能量面成为不同频率的光,因而产生许多系列的谱线。玻尔认为,氨光谱可见光区各谱线(巴耳末系)的产生是由于电子由能级较高的轨道跳回到n=2的轨道放出辐射能的结果。他对这些谱线的波长进行计算,计算值与实验值十分吻合。
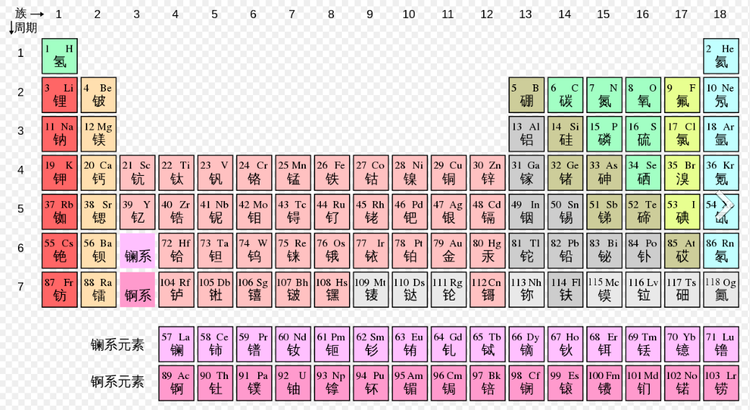
解释元素周期表的性质
1869年,门捷列夫首先提出元素周期表。当时,周期表是按原子量的次序排列起来的,虽然比较粗糙但仍能反映元素性质的周期变化特性。第一个对周期表给予物理解释的是玻尔,他在1916年至1918年期间把元素按电子组态的周期性排列成表,假定原子可以认为是电子被逐个俘获并被束缚而建立起来的。猜测原子的每一个定态轨道上只能容纳有限个电子,并准确预言了 72号元素的存在,并预测了它的性质,有效地解释了化学元素周期表的意义。
激光技术
爱因斯坦于1916年从玻尔的原子结构理论出发,研究了分子的吸收和发射辐射过程,把发射过程分成自发发射和受激发射,然后用统计方法来分析这两种过程,非常方便地推导出普朗克辐射定律。而如果略去受激辐射,就得到了维恩的辐射定律。爱因斯坦这一工作,综合了量子论在第一阶段的成就,而且第一次提出了受激辐射理论。60年代蓬勃发展起来的激光技术,就是以这一理论为基础。