简介
镱元素具有多种同位素,质量数从148到185不等,其中有7种同位素能够稳定存在,即¹⁶⁸Yb、¹⁷ºYb、¹⁷¹Yb、¹⁷²Yb、¹⁷³Yb、¹⁷⁴Yb、¹⁷⁶Yb。
镱与其他稀土金属一起存在于许多稀有矿物中,例如重稀土矿物磷钇矿、褐钇铌矿、离子吸附型稀土矿等矿物中含有少量的镱元素,独居石中也含有微量的镱金属。从矿物质中提取镱元素后需再经过镧热还原-蒸馏法、钙热直接还原法、熔盐电解法等对其提纯。镱在激光元件、光学玻璃、传感器等方面均有应用。
发现历史
1843年,瑞典化学家卡尔·古斯塔夫·莫山德(Carl Gustaf Mosander)从钇土中分离已知的元素后,发现剩余的土质中仍然至少存在三种物质,除去钇元素外,他将另外两种元素命名为Erbia(当时为铽,现今铒)、Terbia(当时为铒,现今铽)。由于物质的相似性,科学家们很快就混淆了Erbia和Terbia,并在1877年左右将它们的名称颠倒过来,莫山德所说的“Erbia”现在被称为“Terbia”,反之亦然。
1878年,瑞士化学家让-夏尔·加利萨·德马里尼亚(Jean-Charles Galissard de Marignac)加热Erbia促使其分解并萃取残余物后得到了两种氧化物,一种为氧化铒,另一种为新元素的氧化物,他将这种新元素命名为“Ytterbium”,该名源自于最早发现镱矿的瑞典Ytterby村。
不幸的是,不同的科学家从相同的实验中获得了不同的结果。法国化学家乔治·乌尔班(Georges Urbain)认为Ytterbium根本不是一种元素,而是两种元素的混合物。1907年,他将Ytterbium分离成两种元素,一种元素命名为Neoytterbium(即新镱),另一种元素为Lutecium(即镥)。但化学家们考虑到德马里尼亚发现镱元素的功劳,最终将镱元素命名为“Ytterbium”,并将“Lutecium”的拼写改为“Lutetium”。
1937年,科学家通过将氯化镱和钾加热在一起,制造了少量的镱金属,但这是不纯的。直到1953年才获得了纯镱金属。
分布情况
稀土元素是分散亲石元素,在海水和植物中的含量极微,主要集中于岩石圈,如花岗岩、碱性岩、碱性超基性岩以及各种矿物等。如轻稀土矿物有氟碳铈矿、独居石、铈铌钙钛矿等,重稀土矿物有磷钇矿、褐钇铌矿、离子吸附型稀土矿等,重稀土矿物和独居石中含有少量的镱金属。镱在地壳中的分布为3.2 mg/kg,在海洋中的含量为8.2×10⁻⁷ mg/L。
物质结构
电子构型
Yb的原子序数为70,核外电子数共有70个,其原子电子构型为1s²2s²2p⁶3s²3p⁶3d¹º4s²4p⁶4d¹º4f¹⁴5s²5p⁶6s²([Xe]4f¹⁴6s²)。Yb原子的4f轨道处于全满的状态,结构较为稳定。此时Yb金属晶体中只有两个6s电子参与成键,因此其熔点、升华晗都比相邻元素的低,原子半径和第三电离能却比相邻元素的大。
镱也能够失去电子成为气态离子,如Yb⁺([Xe]4f¹⁴6s¹)、Yb²⁺([Xe]4f¹⁴)、Yb³⁺([Xe]4f¹³)。Yb³⁺是Yb非常重要的一种离子,因为Yb呈现的主要价态为+3价,此时,Yb失去一个4f电子,但4f轨道被外层的5s²5p⁶惰气壳层屏蔽着,因此在大部分的化学反应中均未被利用。
镱属于镧系元素,具有镧系收缩的特性。镧系收缩是指镧系元素的原子半径和离子半径是随着原子序数的增大而减小的现象,所产生的原因为内层电子对外层电子以及内层电子之间的屏蔽作用不完全。且离子半径的收缩比原子半径的收缩要显著地多,这是因为镧系金属原子失去最外层的6s电子后,4f轨道则处于次外层的,这种状态的4f轨道比原子中的4f轨道对核电荷的屏蔽作用小,从而离子半径的收缩比原子半径的收缩显著地多。
晶体结构
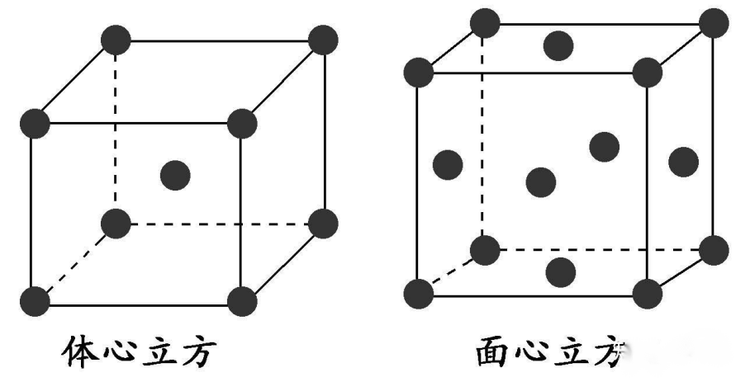
Yb金属在常温常压下为面心立方结构,晶胞参数为a=b=c=5.468,α=β=γ=90°。但是当压力在1.1 GPa及以下时,Yb为半金属态,当压力为1.1-3.9 GPa之间时,Yb为本征半导态,当压力大于3.9 GPa时,Yb又回到金属态,但晶体结构从面心立方结构向体心立方转变。
理化性质
物理性质
镱在常温常压下是一种银色固体,其熔点为819 °C,沸点为1196 °C,常温下密度为6.90 g/cm³,升华热为152.3 kJ/mol,不溶于水和碱,易溶于稀酸。镱金属质地柔软,具有良好的延展性和可塑性。镱金属的导电性能较低且为顺磁性金属。
稀土元素根据质量数和原子序数被分为轻稀土金属(又称为铈组稀土元素)和重稀土金属(又称为钇组稀土金属),镱属于重稀土金属
同位素
镱已被发现多种同位素,质量数从148到185不等,其中有7种同位素能够稳定存在,即¹⁶⁸Yb、¹⁷ºYb、¹⁷¹Yb、¹⁷²Yb、¹⁷³Yb、¹⁷⁴Yb、¹⁷⁶Yb。镱同位素在多个领域均有应用,如¹⁶⁹Yb能够作为伽马相机的辐射源,应力传感器可以制作成光晶格原子钟。
表2:镱同位素的质量数和半衰期
镱同位素 | 质量数 | 半衰期 |
¹⁴⁸Yb | 148 | 250 ms |
¹⁴⁹Yb | 149 | 700 ms |
¹⁵ºYb | 150 | 700 ms |
¹⁵¹Yb | 151 | 1.6 s |
¹⁵²Yb | 152 | 3.03 s |
¹⁵³Yb | 153 | 4.2 s |
¹⁵⁴Yb | 154 | 409 ms |
¹⁵⁵Yb | 155 | 1.793 s |
¹⁵⁶Yb | 156 | 26.1 s |
¹⁵⁷Yb | 157 | 38.6 s |
¹⁵⁸Yb | 158 | 1.49 m |
¹⁵⁹Yb | 159 | 1.67 m |
¹⁶ºYb | 160 | 4.8 m |
¹⁶¹Yb | 161 | 4.2 m |
¹⁶²Yb | 162 | 18.87 m |
¹⁶³Yb | 163 | 11.05 m |
¹⁶⁴Yb | 164 | 75.8 m |
¹⁶⁵Yb | 165 | 9.9 m |
¹⁶⁶Yb | 166 | 56.7 h |
¹⁶⁷Yb | 167 | 17.5 m |
¹⁶⁸Yb | 168 | 稳定 |
¹⁶⁹Yb | 169 | 46 s |
¹⁷ºYb | 170 | 稳定 |
¹⁷¹Yb | 171 | 稳定 |
¹⁷²Yb | 172 | 稳定 |
¹⁷³Yb | 173 | 稳定 |
¹⁷⁴Yb | 174 | 稳定 |
¹⁷⁵Yb | 175 | 4.185 d |
¹⁷⁶Yb | 176 | 稳定 |
¹⁷⁷Yb | 177 | 1.911 h |
¹⁷⁸Yb | 178 | 74 m |
¹⁷⁹Yb | 179 | 8.0 m |
¹⁸ºYb | 180 | 2.4 m |
¹⁸¹Yb | 181 | 1 m |
¹⁸²Yb | 182 | 30 s |
¹⁸³Yb | 183 | 30 s |
¹⁸⁴Yb | 184 | 7 s |
¹⁸⁵Yb | 185 | 5 s |
化学性质
稀土金属镱的化学性质都很活泼,仅次于碱金属和碱土金属,因此金属单质保存时应在表面涂蜡或保存在煤油、惰性气体中,以避免氧化。镱具有较强的还原能力,还原能力接近于镁金属,能够与卤素、氧、硫、氮、硼等多种非金属元素发生还原反应。稀土金属与稀盐酸、稀硝酸、稀硫酸等稀酸的反应剧烈,但不与碱作用。


| 图意 | 易燃的 | 刺激性 |
GHS分类
H228(89.13%):易燃固体
H250(10.87%):暴露在空气中会自燃
H252(10.87%):大量自热;可能着火
H302(89.13%):吞食有害
H312(89.13%):与皮肤接触有害
H315(86.96%):引起皮肤刺激
H319(86.96%):导致严重眼部刺激
H332(89.13%):吸入有害
H335(100%):可能导致呼吸道刺激
健康安全
随着镱的应用在逐渐扩展,镱很容易进入环境,导致镱在河流、土壤和大气中的异常分布。若人体直接接触镱,会引起人类的皮肤和眼睛刺激,若进入人体内则可能会在骨骼、肾脏和肝脏中积累。镱在环境中的积累还会对动植物产生毒性,据实验发现,镱离子对小鼠有一定的神经毒性,并且毒性比镧、钆都要强。镱对部分植物也具有影响,例如高浓度的镱可引起紫背浮萍植物叶片色素含量逐渐下降并影响对矿物质的吸收,还会使蚕豆根尖生长会受到明显抑制作用,破坏叶绿体结构,影响光合作用。